Kaliumacetaat (C2H3KO2) is een verbinding bestaande uit kalium, koolstof, waterstof en zuurstof. Het wordt vaak gebruikt in de voedingsindustrie als conserveermiddel en als ontdooimiddel voor start- en landingsbanen van luchthavens.
| Naam van IUPAC | Kaliumacetaat |
| Moleculaire formule | C2H3KO2 |
| CAS-nummer | 127-08-2 |
| Synoniemen | KAc, kaliumethanoaat |
| InChi | InChI=1S/C2H4O2.K/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Eigenschappen van kaliumacetaat
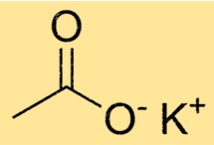
Kaliumacetaatformule
De chemische formule voor kaliumacetaat is C2H3KO2. Het bestaat uit een K+-ion en een CH3COO-ion. Het acetaation is polyatomisch, wat betekent dat het bestaat uit verschillende atomen die aan elkaar zijn gebonden. In het geval van acetaat bestaat het uit twee koolstofatomen, drie waterstofatomen en twee zuurstofatomen.
Kaliumacetaat molaire massa
C2H3KO2 heeft een molaire massa van 98,14 g/mol. Molaire massa is de massa van één mol van een stof en wordt berekend door de atoommassa’s van alle atomen in een molecuul bij elkaar op te tellen. In het geval van C2H3KO2 worden de atoommassa’s van kalium, koolstof, waterstof en zuurstof opgeteld om tot de molaire massa te komen.
Kookpunt van kaliumacetaat
Het kookpunt van C2H3KO2 is 881°C (1618°F). Het kookpunt is de temperatuur waarbij een stof overgaat van een vloeistof naar een gas. C2H3KO2 heeft een relatief hoog kookpunt in vergelijking met andere verbindingen, wat kan worden toegeschreven aan de ionische aard ervan en de sterke aantrekkingskracht tussen positief geladen kaliumionen en negatief geladen acetaationen.
Kaliumacetaat Smeltpunt
Het smeltpunt van C2H3KO2 is 292°C (558°F). Het smeltpunt is de temperatuur waarbij een vaste stof in een vloeistof verandert. C2H3KO2 heeft een relatief hoog smeltpunt, wat kan worden toegeschreven aan de ionische aard ervan en de sterke aantrekkingskracht tussen positief geladen kaliumionen en negatief geladen acetaationen.
Dichtheid van kaliumacetaat g/ml
De dichtheid van C2H3KO2 is 1,57 g/ml. Dichtheid is de massa per volume-eenheid van een stof. De relatief hoge dichtheid van C2H3KO2 kan worden toegeschreven aan de ionische aard ervan en de compacte rangschikking van ionen in het kristalrooster.
Kaliumacetaat Molecuulgewicht
Het molecuulgewicht van C2H3KO2 bedraagt 98,14 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. In het geval van C2H3KO2 is dit de som van de atoomgewichten van kalium, koolstof, waterstof en zuurstof.
Structuur van kaliumacetaat
C2H3KO2 heeft een ionische kristalstructuur. Het bestaat uit positief geladen K+-ionen en negatief geladen CH3COO-ionen. Acetaationen zijn gerangschikt in een vlak, waarbij elk koolstofatoom gebonden is aan een zuurstofatoom en een waterstofatoom. Kaliumionen bevinden zich tussen de vlakken van acetaationen en vormen een driedimensionaal kristalrooster.
| Verschijning | Wit kristallijn poeder |
| Specifieke dichtheid | 1,57 g/cm3 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 98,14 g/mol |
| Dikte | 1,57 g/ml |
| Fusie punt | 292°C (558°F) |
| Kookpunt | 881°C (1618°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol en methanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 4,76 |
| pH | 7 (10% waterige oplossing) |
Kaliumacetaatveiligheid en gevaren
C2H3KO2 wordt over het algemeen als veilig voor menselijk gebruik beschouwd, met een lage toxiciteit en zonder bekende carcinogene of mutagene effecten. Het kan echter irritatie aan de huid en ogen veroorzaken, en langdurige of herhaalde blootstelling kan dermatitis veroorzaken. Het is ook licht irriterend voor de luchtwegen en kan hoesten of kortademigheid veroorzaken als het in grote hoeveelheden wordt ingeademd. Bij inslikken kan het maag-darmirritatie, misselijkheid en braken veroorzaken. Bovendien kan C2H3KO2 reageren met bepaalde chemicaliën en gevaarlijke bijproducten produceren, zoals azijnzuur of kaliumhydroxide. Het moet daarom met zorg worden behandeld en op de juiste manier worden bewaard om contact met onverenigbare stoffen te vermijden.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en vlammen. Vermijd inslikken, inademen en contact met huid en ogen. Draag handschoenen en een veiligheidsbril. |
| EEN ID | UN2923 |
| HS-code | 2915.29.10 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | III |
| Toxiciteit | Lage toxiciteit. Kan huid, ogen en luchtwegen irriteren. Inslikken kan maag-darmirritatie, misselijkheid en braken veroorzaken. |
Synthesemethoden voor kaliumacetaat
Om C2H3KO2 te synthetiseren, moet men kaliumhydroxide neutraliseren met azijnzuur , kaliumcarbonaat laten reageren met azijnzuur, of kaliummetaal laten reageren met azijnzuur.
Bij de neutralisatiemethode wordt azijnzuur langzaam toegevoegd aan een oplossing van kaliumhydroxide totdat de pH een neutraal niveau bereikt. Dit proces leidt tot de vorming van C2H3KO2 en water. Vervolgens verdampt de onderzoeker de resulterende oplossing en verkrijgt een witte kristallijne vaste stof van C2H3KO2.
Bij deze methode vereist het proces het volledig verwarmen van een mengsel van azijnzuur en kaliumcarbonaat . Filtreer daarna het mengsel om de resterende vaste stoffen te verwijderen, damp vervolgens in en kristalliseer om C2H3KO2 te verkrijgen.
De reactie van kaliummetaal met azijnzuur is een andere methode om C2H3KO2 te synthetiseren. Het proces omvat het toevoegen van metallisch kalium aan een azijnzuuroplossing, die C2H3KO2 en waterstofgas produceert. Vervolgens maakt het verdampen van de oplossing en het kristalliseren van de C2H3KO2 de extractie ervan mogelijk.
Gebruik van kaliumacetaat
C2H3KO2 heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
Ontdooimiddel: Wordt vaak gebruikt als ontijzingsmiddel op start- en landingsbanen, bruggen en andere oppervlakken van luchthavens waar traditionele op zout gebaseerde ontdooimiddelen schadelijk kunnen zijn voor het milieu.
Voedselconserveringsmiddel: gebruikt als voedselconserveringsmiddel om bederf te voorkomen en de houdbaarheid van bepaalde voedingsmiddelen te verlengen.
Buffermiddel: gebruikt als buffermiddel in verschillende industrieën, waaronder de farmaceutische industrie, textiel en cosmetica.
Katalysator: Gebruikt als katalysator bij de productie van bepaalde chemicaliën, zoals azijnzuuranhydride.
Laboratoriumreagens: Een veelgebruikt laboratoriumreagens voor verschillende analytische en onderzoeksdoeleinden.
Diervoederadditief: Gebruikt als voeradditief voor vee, vooral in pluimvee- en varkensdiëten, om de groei en de algehele gezondheid te verbeteren.
Vlamvertrager: Wordt gebruikt als vlamvertrager in sommige kunststoffen en textiel om het risico op brand te verminderen.
Medische toepassingen: Wordt ook gebruikt in sommige medische toepassingen, zoals de behandeling van hypokaliëmie (lage kaliumspiegels) en als onderdeel van sommige dialyseoplossingen.
Vragen:
Vraag: Is kaliumacetaat oplosbaar?
A: Ja, C2H3KO2 is oplosbaar in water.
Vraag: Wat is de formule voor kaliumacetaat?
A: De formule voor kaliumacetaat is CH3CO2K.
Vraag: Waar wordt kaliumacetaat voor gebruikt?
A: C2H3KO2 wordt voor verschillende doeleinden gebruikt, waaronder ontdooimiddel, voedselconserveermiddel, buffermiddel, katalysator, laboratoriumreagens, additief voor diervoeding, vlamvertrager en in sommige medische toepassingen.
Vraag: Is kaliumacetaat oplosbaar in water?
A: Ja, C2H3KO2 is oplosbaar in water.
Vraag: Is kaliumacetaat een zuur of een base?
A: C2H3KO2 is noch een zuur, noch een base, maar kan fungeren als buffermiddel om een stabiele pH in oplossingen te helpen handhaven.
