Jodiumwaterstofzuur (HI) is een sterk zuur gevormd uit waterstof en jodium. Het wordt gebruikt bij de organische synthese en als reductiemiddel. Het is zeer corrosief en vereist een zorgvuldige behandeling.
| IUPAC-naam | Waterstofzuur |
| Moleculaire formule | HOI |
| CAS-nummer | 10034-85-2 |
| Synoniemen | Waterstofjodide, waterstofjodide, jodaan |
| InChi | InChI=1S/HI/h1H |
Eigenschappen van waterstofjodide
Hydrojodiumzuurformule
De chemische formule voor waterstofjodide is HI. Het bestaat uit een waterstofatoom (H) gebonden aan een jodiumatoom (I). Deze eenvoudige formule vertegenwoordigt de samenstelling van dit sterke zuur.
Waterstofzuur molaire massa
De molaire massa van waterstofjodide (HI) is ongeveer 127,91 gram per mol (g/mol). Deze waarde wordt berekend door de atoommassa’s van een waterstofatoom en een jodiumatoom bij elkaar op te tellen.
Kookpunt van waterstofjodidezuur
Waterstofjodide heeft een relatief laag kookpunt, ongeveer -35 graden Celsius (-31 graden Fahrenheit). Bij deze temperatuur verandert de vloeibare vorm van HI in de gasvormige toestand.
Waterstofzuur Smeltpunt
Het smeltpunt van waterstofjodide is ongeveer -51 graden Celsius (-60 graden Fahrenheit). Bij deze temperatuur verandert de vaste vorm van HI in een vloeibare toestand.
Dichtheid van waterstofjodide g/ml
De dichtheid van waterstofjodide is ongeveer 2,85 gram per milliliter (g/ml). Deze dichtheidsmeting geeft de massa van HI aan die aanwezig is in één milliliter van de stof.
Waterstofzuur Molecuulgewicht
Waterstofjodide heeft een molecuulgewicht van ongeveer 127,91 g/mol. Deze waarde is de som van de atoomgewichten van waterstof en jodium in het HI-molecuul.
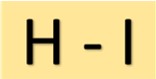
Structuur van waterstofjodide
Jodiumwaterstofzuur (HI) heeft een eenvoudige structuur. Het bestaat uit een waterstofatoom dat via een enkele covalente binding aan een jodiumatoom is gekoppeld. Deze moleculaire rangschikking geeft HI zijn karakteristieke eigenschappen.
Oplosbaarheid van waterstofjodide
Waterstofzuur heeft een hoge oplosbaarheid in water. Wanneer het met water wordt gemengd, lost het gemakkelijk op en vormt een kleurloze oplossing. De hoge oplosbaarheid draagt bij aan het wijdverbreide gebruik ervan in verschillende toepassingen, waaronder chemische synthese.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 2,85 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 127,91 g/mol |
| Dikte | 2,85 g/ml |
| Fusie punt | -51°C (-60°F) |
| Kookpunt | -35°C (-31°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Mengbaar en vormt een kleurloze oplossing |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | -tien |
| pH | Zeer zuur (pH < 1) |
Veiligheid en gevaren van waterstofjodidezuur
Waterstofjodide (HI) brengt aanzienlijke veiligheidsrisico’s met zich mee vanwege de corrosieve aard ervan. Het kan bij contact ernstige brandwonden en oogletsel veroorzaken. Inademing van de dampen veroorzaakt irritatie van de luchtwegen. Bij het hanteren van HI moeten geschikte beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gebruikt. Het moet worden opgeslagen in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen. Indien per ongeluk ingeslikt of ingeademd, dient u onmiddellijk medische hulp in te roepen. Indien gemorst, neutraliseer met geschikte middelen en verwijder het als gevaarlijk afval. Het is essentieel om strikte veiligheidsprotocollen te volgen en er voorzichtig mee om te gaan om ongelukken en verwondingen te voorkomen.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Veroorzaakt ernstige brandwonden en oogletsel. Schadelijk bij inademing. |
| VN-identificatienummers | VN1787 |
| HS-code | 28111990 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van waterstofjodide
Waterstofjodide (HI) kan op verschillende manieren worden gesynthetiseerd. Een gebruikelijke aanpak omvat de directe reactie van jodium (I2) met rode fosfor (P). Bij deze methode wordt I2 gemengd met rode fosfor, dat als reductiemiddel werkt. De reactie vindt plaats in aanwezigheid van water, waardoor HI en fosforzuur ontstaan.
Een andere methode omvat de reactie van jodium met hydrazinehydraat (N2H4·H2O). Dit proces vereist een zorgvuldige behandeling vanwege de potentieel gevaarlijke aard van hydrazinehydraat. De reactie resulteert in de vorming van HI en stikstofgas.
Als alternatief kan de reactie van jodium met geconcentreerd zwavelzuur (H2SO4) ook HI produceren. Bij deze methode wordt jodium gemengd met geconcentreerd zwavelzuur, wat leidt tot de vorming van HI-gas, dat kan worden opgevangen en gecondenseerd tot vloeibare vorm.
Het is essentieel op te merken dat de synthese van waterstofjodide moet worden uitgevoerd met passende veiligheidsmaatregelen. De betrokken chemicaliën kunnen gevaarlijk zijn en de reacties kunnen giftige gassen genereren. Goede ventilatie, beschermende uitrusting en naleving van veiligheidsmaatregelen zijn cruciaal tijdens het syntheseproces om een veilige en succesvolle productie van waterstofjodide te garanderen.
Gebruik van waterstofjodidezuur
Waterstofjodide (HI) vindt vanwege zijn unieke eigenschappen diverse toepassingen in diverse industrieën. Hier zijn enkele belangrijke toepassingen:
- Organische synthese: De organische chemie gebruikt HI als een essentiële reactant om alkylhalogeniden om te zetten in alkanen, een proces dat bekend staat als dehalogenering.
- Farmaceutische industrie: De productie van verschillende farmaceutische verbindingen, waaronder jodiumhoudende medicijnen en jodiumhoudende contrastmiddelen voor medische beeldvorming, gerelateerd aan HI.
- Reductiemiddel: HI functioneert actief als een krachtig reductiemiddel bij chemische reacties en helpt bij de reductie van metaalionen tot hun elementaire vormen.
- Katalyse: HI neemt actief deel als katalysator bij bepaalde chemische reacties, waardoor de reactiesnelheden toenemen en de opbrengst van specifieke transformaties wordt verbeterd.
- Reinigen en etsen: De elektronica- en halfgeleiderindustrie maakt actief gebruik van HI voor reinigings- en etsprocessen vanwege het vermogen ervan om metalen en metaaloxiden op te lossen.
- Analytische chemie: Iodometrische titraties in de analytische chemie maken actief gebruik van HI om de concentratie van bepaalde stoffen te bepalen op basis van hun reactie met jodium.
- Metaaloppervlaktebehandeling: HI speelt actief een rol bij het voorbereiden van metalen oppervlakken voor galvaniseren, hardsolderen en andere oppervlaktebehandelingsprocessen.
- Jodideproductie: Verschillende industrieën gebruiken HI actief om jodideverbindingen te produceren voor verschillende toepassingen op gebieden zoals fotografie, geneeskunde en organische synthese.
- Laboratoriumreagens: Laboratoria gebruiken HI actief als een nuttig reagens voor veel chemische reacties en experimenten.
De veelzijdige eigenschappen van waterstofjodide maken het tot een waardevol hulpmiddel bij chemisch onderzoek, industriële processen en farmaceutische ontwikkeling, en dragen bij aan vooruitgang in meerdere sectoren en wetenschappelijke ontdekkingen.
Vragen:
Vraag: Welke verbinding kan aan waterstofjodide (HI) worden toegevoegd om de zure eigenschappen ervan te neutraliseren?
A: Een base, zoals natriumhydroxide (NaOH), kan worden toegevoegd om het waterstofjodide te neutraliseren en water en een zout te vormen.
Vraag: Is waterstofjodide een sterk zuur?
A: Ja, waterstofjodide is een sterk zuur, wat betekent dat het volledig ioniseert in water, waarbij waterstofionen vrijkomen.
Vraag: Wat is de formule voor waterstofjodide?
A: De formule voor waterstofjodide is HI, wat staat voor een waterstofatoom gebonden aan een jodiumatoom.
Vraag: Welke van de volgende is de formule voor waterstofjodide?
A: De formule voor waterstofjodide is HI.
Vraag: Hoeveel milliliter 0,550 M joodwaterstofzuur zijn nodig om te reageren met 10,00 ml 0,217 M CsOH?
A: Er is ongeveer 17,58 ml 0,550 M waterstofjodide nodig om te reageren met 10,00 ml 0,217 M CsOH.
Vraag: Is waterstofjodide illegaal?
A: Waterstofjodide zelf is niet illegaal, maar het gebruik en bezit ervan kan aan regelgeving onderhevig zijn vanwege de potentiële gevaren en toepassingen ervan bij illegale activiteiten.
Vraag: Wat vormen waterstofjodide en magnesiumsulfide?
A: Waterstofjodide en magnesiumsulfide reageren om waterstofsulfide (H2S) gas en magnesiumjodidezout (MgI2) te vormen.
Vraag: Wat gebeurt er als je waterstofjodide mengt met zuiveringszout?
A: Wanneer waterstofjodide reageert met zuiveringszout (natriumbicarbonaat), produceert het koolstofdioxide, water en natriumjodide.
Vraag: Hoe werkt waterstofjodide in water?
A: Waterstofjodide ioniseert in water, waarbij waterstofionen (H+) en jodide-ionen (I-) vrijkomen, wat resulteert in een zeer zure oplossing.
Vraag: Netto ionische vergelijking van natriumhydroxide en waterstofjodide?
A: De netto ionische vergelijking voor de reactie tussen natriumhydroxide (NaOH) en waterstofjodide (HI) is Na+ + OH- + H+ + I- → Na+ + I- + H2O.
