IJzer III-nitraat is een chemische verbinding. Het wordt gevormd door ijzerionen te combineren met nitraationen. Het wordt vaak gebruikt in industriële toepassingen en als laboratoriumreagens.
| IUPAC-naam | IJzer(III)nitraat |
| Moleculaire formule | Fe(NO3)3 |
| CAS-nummer | 10421-48-4 |
| Synoniemen | IJzernitraat, ijzertrinitraat, ijzer(III)zout van salpeterzuur |
| InChi | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Eigenschappen van ijzer (III) nitraat
IJzer(III)nitraatformule
De formule voor ijzer III-nitraat is Fe(NO3)3. Het bestaat uit één ijzerion (Fe) en drie nitraationen (NO3). Deze formule vertegenwoordigt de combinatie van het ijzerkation met de nitraatanionen.
IJzer(III)nitraat Molaire massa
De molaire massa van ijzernitraat kan worden berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. IJzer (Fe) heeft een molaire massa van 55,845 g/mol, terwijl elk nitraation (NO3) een molaire massa heeft van 62,0049 g/mol. Optelling van deze waarden geeft een molaire massa van ongeveer 241,86 g/mol voor ijzernitraat.
Kookpunt van ijzer(III)nitraat
IJzernitraat heeft geen specifiek kookpunt. Bij verhitting valt het uiteen in verschillende stikstofoxiden en vormt uiteindelijk ijzeroxide. De ontledingstemperatuur is afhankelijk van factoren zoals de concentratie en de aanwezigheid van andere stoffen.
Smeltpunt van ijzer(III)nitraat
Het smeltpunt van ijzernitraat is ongeveer 47°C (117°F). Bij deze temperatuur verandert de vaste verbinding in de vloeibare toestand. Het is belangrijk op te merken dat het smeltpunt enigszins kan variëren, afhankelijk van factoren zoals onzuiverheden of de exacte samenstelling van de verbinding.
Dichtheid van ijzer(III)nitraat g/ml
De dichtheid van Fe(NO3)3 bedraagt ongeveer 1,68 g/ml. Dichtheid vertegenwoordigt de massa per volume-eenheid van een stof. In dit geval geeft het de massa Fe(NO3)3 per milliliter van de verbinding aan.
IJzer (III) Nitraat Moleculair gewicht
Het molecuulgewicht van ijzernitraat is ongeveer 241,86 g/mol. Molecuulgewicht verwijst naar de som van de atoomgewichten van alle atomen in een molecuul.
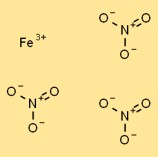
Structuur van ijzer(III)nitraat
IJzernitraat heeft in vaste vorm een kristallijne structuur. Het bestaat uit Fe3+-kationen omgeven door gecoördineerde nitraatanionen (NO3-). De ijzerkationen worden bij elkaar gehouden door ionische bindingen, terwijl de nitraatanionen door elektrostatische krachten tot de kationen worden aangetrokken.
Oplosbaarheid van ijzer(III)nitraten
IJzernitraat is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een heldere, lichtgele oplossing. De oplosbaarheid van ijzernitraat in andere oplosmiddelen of stoffen kan variëren.
| Verschijning | Lichtgele kristallen |
| Soortelijk gewicht | 1,68 |
| Kleur | Bleek geel |
| Geur | Geurloos |
| Molaire massa | 241,86 g/mol |
| Dikte | 1,68 g/ml |
| Fusie punt | 47°C (117°F) |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water en polaire oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Zuur |
Veiligheid en gevaren van ijzer(III)nitraat
IJzernitraat brengt enkele veiligheidsrisico’s met zich mee en er moet voorzichtig mee worden omgegaan. Het wordt beschouwd als irriterend voor de huid, ogen en luchtwegen. Direct contact met de verbinding moet worden vermeden en er moet beschermende uitrusting zoals handschoenen en een veiligheidsbril worden gedragen. Het innemen of inademen van ijzernitraat kan schadelijke effecten veroorzaken en mag daarom niet worden ingenomen of ingeademd. Het is belangrijk om met dit middel te werken in een goed geventileerde ruimte om het risico op inademing te minimaliseren. In geval van accidentele blootstelling of inslikken moet onmiddellijk medische hulp worden ingeroepen. Om de veiligheid te garanderen, moeten de juiste opslag- en hanteringspraktijken worden gevolgd.
| Gevarensymbolen | Xi, O |
| Beveiligingsbeschrijving | Veroorzaakt huid- en oogirritatie. Kan irritatie van de luchtwegen veroorzaken. Schadelijk bij inslikking. |
| VN-identificatienummers | UN 1466 (watervrij) |
| HS-code | 28342990 |
| Gevarenklasse | 5.1 (Oxidatiemiddel) |
| Verpakkingsgroep | II |
| Toxiciteit | Matige toxiciteit |
Methoden voor de synthese van ijzer(III)nitraat
IJzernitraat kan op verschillende manieren worden gesynthetiseerd. De gebruikelijke methode is het oplossen van ijzer(III)oxide (Fe2O3) in geconcentreerd salpeterzuur (HNO3). Deze reactie resulteert in de vorming van ijzernitraat, weergegeven door de vergelijking:
Geconcentreerd salpeterzuur lost ijzer(III)oxide op en produceert zowel Fe(NO3)3 als water:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Een andere methode omvat het combineren van metallisch ijzer met een mengsel van salpeterzuur en waterstofperoxide, dat het ijzer oxideert om ijzernitraat te vormen. Deze bekende reactie verdient de naam ‘aqua regia’-methode.
Het toevoegen van metallisch ijzer aan een mengsel van salpeterzuur en waterstofperoxide leidt tot de productie van ijzernitraat en water:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
Het is van cruciaal belang om voorzichtig te zijn bij het uitvoeren van deze reacties vanwege de corrosieve en oxiderende aard van de betrokken chemicaliën. Het is noodzakelijk om de juiste veiligheidsmaatregelen te volgen, zoals het dragen van beschermende kleding en het werken in een goed geventileerde ruimte.
Gerenommeerde chemische leveranciers bieden commercieel verkrijgbaar ijzernitraat aan, waardoor een consistente en betrouwbare bron van de verbinding voor verschillende toepassingen in industrieën en laboratoria wordt gegarandeerd.
Gebruik van ijzer(III)nitraat
IJzernitraat heeft verschillende praktische toepassingen in verschillende industrieën en laboratoria. Hier zijn enkele belangrijke toepassingen van ijzernitraat:
- Industriële katalysator: Verschillende industriële processen, waaronder de productie van nylon en andere polymeren, gebruiken ijzernitraat als katalysator.
- Verven en pigmenten: De verf- en pigmentindustrie gebruikt ijzernitraat als bijtmiddel om kleurstoffen aan stoffen te fixeren en de kleurechtheid te verbeteren.
- Etsmiddel: De metaalbewerkings- en elektronica-industrie gebruikt ijzernitraat als etsmiddel om ingewikkelde patronen en ontwerpen op metalen oppervlakken te creëren.
- Laboratoriumreagens: IJzernitraat dient als een algemeen laboratoriumreagens voor verschillende chemische reacties en experimenten, vooral voor de synthese van andere verbindingen.
- Oxidatiemiddel: IJzernitraat werkt als oxidatiemiddel bij chemische reacties, inclusief organische synthese, vanwege zijn sterke oxiderende eigenschappen.
- Waterbehandeling: IJzernitraat is nuttig in waterbehandelingsprocessen om onzuiverheden, zoals fosfaten en sulfiden, uit industrieel afvalwater te verwijderen.
- Fotografie: Bij sommige fotografische processen, met name bij de bereiding van fotografische emulsies op ijzerbasis, wordt ijzernitraat gebruikt.
- Analytische chemie: IJzernitraat vindt toepassingen in analytische chemische technieken, zoals colorimetrische analyse, om specifieke stoffen te detecteren en te kwantificeren.
- Houtverduurzaming: Houtverduurzamingsbehandelingen gebruiken ijzernitraat als het actieve ingrediënt om hout te beschermen tegen schimmelrot en insectenplagen.
- Farmaceutische toepassingen: Bij de formulering van bepaalde farmaceutische producten en medicijnen wordt ijzernitraat gebruikt.
Het is belangrijk op te merken dat de juiste hantering en veiligheidsmaatregelen moeten worden gevolgd bij het werken met ijzernitraat vanwege de corrosieve en oxiderende aard ervan.
Vragen:
Vraag: Is ijzer(III)nitraat brandbaar?
A: Nee, ijzernitraat is niet brandbaar.
Vraag: Wat zijn de veiligheids- en hanteringsproblemen met ijzer(III)nitraat?
A: Veiligheidsproblemen omvatten irritatie van de huid, ogen en luchtwegen. Daarom moet er met de juiste beschermende uitrusting en voorzorgsmaatregelen mee worden omgegaan.
Vraag: Welke formule vertegenwoordigt ijzer(III)nitraat?
A: De formule voor ijzernitraat is Fe(NO3)3.
Vraag: Wat is de formule voor ijzer(III)nitraat?
A: De formule voor ijzer(III)nitraat is Fe(NO3)3.
Vraag: Wat is de molaire massa van ijzer(III)nitraat?
A: De molaire massa van Fe(NO3)3 is ongeveer 241,86 g/mol.
Vraag: Is ijzerhydroxide oplosbaar in water?
A: IJzerhydroxide is slecht oplosbaar in water.
Vraag: Reageert het met ijzer(III)nitraat?
A: Nee, calcium (Ca) reageert over het algemeen niet met Fe(NO3)3.
Vraag: Met welk deel van aspirine reageert ijzer(III)nitraat?
A: IJzer(III)nitraat reageert met de carboxylaatgroep (-COO-) die aanwezig is in het aspirinemolecuul.
Vraag: Wat is de molecuulmassa van ijzer(III)nitraat?
A: De molecuulmassa van Fe(NO3)3 is ongeveer 241,86 g/mol.
Vraag: Reageert Al met ijzer(III)nitraat?
A: Ja, aluminium (Al) kan reageren met Fe(NO3)3 en zo aluminiumnitraat en metallisch ijzer vormen.
Vraag: Hoeveel mol nitraat is opgelost in 50,0 g water in een ijzer(III)nitraatoplossing van 3,80 M?
A: Om het aantal mol nitraat te bepalen, is het volume van de oplossing nodig, omdat alleen de molariteit en de massa van het water worden vermeld.
