IJzer(III)hydroxide is een verbinding die wordt gevormd door de reactie van ijzer met water. Het wordt vaak gebruikt in farmaceutische producten, bij waterbehandeling en als pigment in verven.
| IUPAC-naam | IJzer(III)hydroxide |
| Moleculaire formule | Fe(OH)₃ |
| CAS-nummer | 20344-49-4 |
| Synoniemen | IJzerhydroxide, ijzertrihydroxide, ijzerhydraat, ijzer (III) oxyhydroxide |
| InChi | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Eigenschappen van ijzer(III)hydroxide
IJzer(III)hydroxideformule
De formule voor ijzer(III)hydroxide is Fe(OH)₃. Dit geeft aan dat elk Fe(OH)3-molecuul bestaat uit één Fe-atoom gebonden aan drie OH-ionen.
Molaire massa ijzer(III)hydroxide
De molaire massa van Fe(OH)₃ kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. IJzer heeft een molaire massa van 55,845 g/mol en elk hydroxide (OH)-ion heeft een molaire massa van 17,007 g/mol. Daarom is de molaire massa van Fe(OH)3 ongeveer 106,867 g/mol.
Kookpunt van ijzer(III)hydroxide
Fe(OH)₃ heeft geen goed gedefinieerd kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. In plaats daarvan ondergaat het thermische ontleding en vormt het bij verhitting ijzer(III)oxide en water.
Smeltpunt van ijzer(III)hydroxide
Fe(OH)₃ ontleedt ook bij verhitting en heeft geen duidelijk smeltpunt. Het wordt bij hoge temperaturen omgezet in ijzer(III)oxide en water.
Dichtheid van ijzer(III)hydroxide g/ml
De dichtheid van Fe(OH)₃ hangt af van verschillende factoren, zoals de fysieke toestand (vast of oplossing) en de concentratie. De dichtheid van een vaste vorm van Fe(OH)3 is ongeveer 3,4 g/ml.
Molecuulgewicht ijzer(III)hydroxide
Het molecuulgewicht van Fe(OH)₃ wordt berekend door de atoomgewichten van de samenstellende atomen op te tellen. Het molecuulgewicht van Fe(OH)3 bedraagt ongeveer 106,867 g/mol.
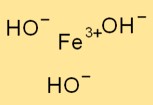
Structuur van ijzer(III)hydroxide
Fe(OH)₃ heeft een trigonale structuur, waarbij een ijzeratoom omgeven is door drie hydroxide-ionen. Het ijzeratoom fungeert als het centrale atoom en de hydroxide-ionen zijn ermee verbonden door ionische bindingen.
Oplosbaarheid van ijzer(III)hydroxide
Fe(OH)₃ heeft een beperkte oplosbaarheid in water. Het vormt een neerslag wanneer het in water wordt opgelost en de oplosbaarheid ervan hangt af van verschillende factoren zoals temperatuur, pH en de aanwezigheid van andere ionen. De oplosbaarheid van Fe(OH)3 neemt toe onder zure omstandigheden.
| Verschijning | Stevig bruin |
| Soortelijk gewicht | 3.4 |
| Kleur | Bruin |
| Geur | Geurloos |
| Molaire massa | 106.867 g/mol |
| Dikte | 3,4 g/ml |
| Fusie punt | Ontbonden |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Onoplosbaar. Hangt af van factoren zoals temperatuur, pH en de aanwezigheid van andere ionen |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Ongeveer 5-7 |
Veiligheid en gevaren van ijzer(III)hydroxide
Fe(OH)₃ brengt bepaalde veiligheidsoverwegingen en gevaren met zich mee. Algemeen wordt aangenomen dat het een lage toxiciteit heeft. Inslikken of inademen van grote hoeveelheden kan echter gastro-intestinale irritatie en ademhalingsproblemen veroorzaken. Het is belangrijk om contact met de ogen en de huid te vermijden, omdat dit irritatie kan veroorzaken. In geval van contact de getroffen gebieden met veel water afspoelen. Bij het hanteren van Fe(OH)₃ is het raadzaam geschikte beschermende uitrusting te dragen, zoals handschoenen en een veiligheidsbril, om het risico op blootstelling te minimaliseren. Er moet voor voldoende ventilatie worden gezorgd om ophoping van stof te voorkomen. Bovendien is het essentieel om de veiligheidsmaatregelen te volgen en voorzichtig met Fe(OH)₃ om te gaan om potentiële risico’s te minimaliseren.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | – Vermijd contact met ogen en huid <br> – Draag beschermende uitrusting <br> – Zorg voor voldoende ventilatie |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2821.10.0000 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor de synthese van ijzer(III)hydroxide
Er zijn verschillende methoden om Fe(OH)₃ te synthetiseren. Een veelgebruikte methode omvat de precipitatiereactie tussen een ijzerzout en een base. Door bijvoorbeeld een oplossing van ijzerchloride (FeCl3) toe te voegen aan een oplossing van natriumhydroxide (NaOH) kan Fe(OH)3 worden gevormd. De reactie verloopt als volgt:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Bij een andere methode kan ijzer(II)hydroxide worden geoxideerd tot Fe(OH)3 door het aan lucht bloot te stellen of te behandelen met een oxidatiemiddel. De reactie verloopt als volgt:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Daarnaast kan Fe(OH)3 worden bereid door een ijzerzoutoplossing te hydrolyseren. Bij dit proces wordt water aan de ijzerzoutoplossing toegevoegd, waardoor een neerslag van Fe(OH)3 ontstaat. De reactie verloopt als volgt:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Deze synthesemethoden bieden manieren om Fe(OH)3 te verkrijgen voor verschillende toepassingen, waaronder farmaceutische producten, waterbehandeling en als pigment in verven. Het is belangrijk om tijdens het syntheseproces de juiste veiligheidsmaatregelen te volgen en op verantwoorde wijze met chemicaliën om te gaan.
Gebruik van ijzer(III)hydroxide
Fe(OH)₃ kent diverse toepassingen vanwege zijn unieke eigenschappen. Hier zijn enkele veelvoorkomende toepassingen van Fe(OH)₃:
- Farmaceutische industrie: De farmaceutische industrie gebruikt Fe(OH)₃ bij de productie van ijzersupplementen en medicijnen, zoals die worden gebruikt voor de behandeling van bloedarmoede door ijzertekort.
- Waterbehandeling: Waterbehandelingsprocessen gebruiken Fe(OH)₃ om verontreinigingen en onzuiverheden te verwijderen. Fe(OH)₃ werkt als vlokmiddel en helpt bij het agglomereren en verwijderen van zwevende deeltjes in water.
- Pigment in verven: Fe(OH)₃ vindt met zijn bruine kleur toepassing als pigment in verven, coatings en kleurstoffen. Het geeft een scala aan aardse tinten en is vooral nuttig voor het produceren van oker- en siennakleuren.
- Afvalwaterzuivering: Afvalwaterzuiveringsinstallaties gebruiken Fe(OH)₃ om fosfaten en verontreinigingen met zware metalen uit industrieel afvalwater te verwijderen.
- Katalyse: Fe(OH)₃ werkt als katalysator bij verschillende chemische reacties, waaronder de ontleding van waterstofperoxide en oxidatiereacties.
- Adsorbens: Fe(OH)₃ dient als adsorberend materiaal om onzuiverheden, verontreinigingen en kleurstoffen uit oplossingen te verwijderen.
- Bodemverbetering: Fe(OH)₃ werkt als bodemverbetering om de bodemvruchtbaarheid en beschikbaarheid van voedingsstoffen te verbeteren. Het verbetert het vermogen om voedingsstoffen vast te houden in de bodem en levert essentieel ijzer voor de plantengroei.
- Laboratoriumreagens: In het laboratorium gebruiken onderzoekers en analisten Fe(OH)₃ als reagens voor een verscheidenheid aan analytische en onderzoeksdoeleinden, waaronder neerslagreacties en pH-aanpassing.
De veelzijdige toepassingen van Fe(OH)₃ benadrukken het belang ervan in verschillende industrieën en de bijdrage ervan aan verschillende processen, variërend van farmaceutische producten tot milieuhygiëne.
Vragen:
Vraag: Wat is het juiste gewicht voor de ijzer(III)hydroxideformule?
A: Het juiste formulegewicht voor Fe(OH)₃ is ongeveer 106,867 g/mol.
Vraag: Wat is de volledige ionische vergelijking voor de reactie tussen FeBr3 en bariumhydroxide?
A: De volledige ionische vergelijking voor de reactie tussen FeBr3 en bariumhydroxide is FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
Vraag: Welke massa ijzer(III)hydroxideneerslag kan worden geproduceerd door 75,0 ml te laten reageren?
A: Om de massa van het Fe(OH)3-precipitaat te bepalen, is aanvullende informatie nodig, zoals de concentratie of molariteit van de reactanten.
Vraag: Hoe vorm ik ijzer(III)hydroxide?
A: Fe(OH)3 kan op verschillende manieren worden gevormd, waaronder precipitatiereacties tussen ijzerzouten en basen, oxidatie van Fe(OH)2 of hydrolyse van een ijzerzoutoplossing.
Vraag: Is ijzer(III)hydroxide oplosbaar?
A: Nee, Fe(OH)₃ is niet oplosbaar in water. Het vormt een neerslag wanneer het in water wordt opgelost.
Vraag: Hoeveel gram Fe(OH)₃ zit er in 4,61 gram Fe³⁺?
A: Om het aantal gram Fe(OH)₃ te bepalen, zijn de molaire massa van Fe³⁺ en de stoichiometrie van de reactie nodig.
Vraag: Welke kleur heeft Fe(OH)₃?
A: Fe(OH)₃ is over het algemeen bruin van kleur.
Vraag: Is ijzerhydroxide een vaste stof?
A: Ja, ijzerhydroxide bestaat in vaste vorm.
Vraag: Wat produceert thermisch afgebroken ijzerhydroxide?
A: Thermisch afgebroken Fe(OH)₃ produceert ijzer(III)oxide (Fe₂O₃) en water.
Vraag: Is ijzerhydroxide oplosbaar in water?
A: Nee, ijzerhydroxide is niet oplosbaar in water. Wanneer het met water wordt gemengd, vormt het een neerslag.
