Fluorantimoonzuur is een van de krachtigste superzuren die we kennen, met een Hammett-zuurgraadfunctie van -21. Het is een mengsel van waterstoffluoride en antimoonpentafluoride.
| IUPAC-naam | Fluorantimoonzuur (V) |
| Moleculaire formule | H[SbF6] |
| CAS-nummer | 16950-06-4 |
| Synoniemen | Waterstofhexafluorantimonaat (V), Gehydrateerd antimoonhexafluoride, Antimoonwaterstoffluoride, Fluorwaterstofzuur met pentafluorantimoon (1:1) |
| InChi | InChI=1S/F6Sb.H/h1H;/q+1;/p-1 |
pH van fluorantimoonzuur
Fluorantimoonzuur is een superzuur en heeft een pH lager dan -14. Dit komt omdat de pH-schaal de concentratie waterstofionen (H+) in een oplossing meet en superzuren hogere concentraties H+-ionen hebben dan zuiver water.
Traditionele pH-meters kunnen de pH van fluorantimoonzuur niet nauwkeurig meten, omdat ze niet zijn ontworpen om zulke sterke zuren te verwerken. In plaats daarvan gebruiken wetenschappers de Hammett-zuurgraadfunctie om de zuurgraad van fluorantimoonzuur te meten. De Hammett-zuurgraadfunctie vergelijkt de zuurgraad van superzuren met behulp van de mate van protonering van een referentieverbinding. Fluorantimoonzuur heeft een Hammett-zuurgraadfunctie van -21, wat de meest negatieve waarde is die mogelijk is en aangeeft dat het een van de krachtigste bekende superzuren is.
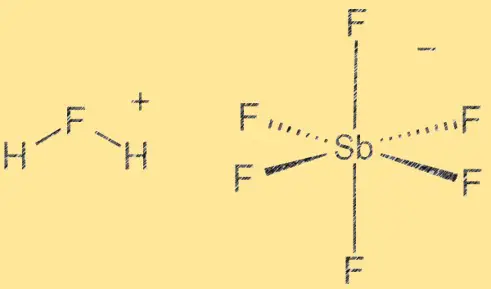
Structuur van fluorantimoonzuur:
Fluorantimonzuur heeft een moleculaire structuur die bestaat uit een waterstofion (H+) en een hexafluorantimonaat (V)-ion ([SbF6]^-). Het SbF6-ion werkt als een Lewis-zuur, terwijl het H+-ion werkt als een Bronsted-zuur. De verbinding is zeer polair vanwege het verschil in elektronegativiteit tussen waterstof- en fluoratomen. De binding tussen antimoon en fluoride is covalent, terwijl de binding tussen waterstof en fluoride polair covalent is.
Molaire massa van fluorantimonzuur:
Fluorantimoonzuur heeft een molaire massa van 216,74 g/mol. Het is een zeer reactief en corrosief superzuur bestaande uit waterstoffluoride (HF) en antimoonpentafluoride (SbF5). De hoge molaire massa van fluorantimoonzuur kan worden toegeschreven aan de aanwezigheid van het zware antimoonatoom in zijn moleculaire structuur.
Kookpunt van fluorantimoonzuur:
HSbF6 is een zeer reactieve en onstabiele verbinding en heeft daarom geen gedefinieerd kookpunt. Het ontleedt bij temperaturen boven -10°C, waarbij giftige dampen van waterstoffluoridegas vrijkomen. Het kookpunt wordt geschat op ongeveer 20-30°C, maar dit is geen bruikbare parameter om de eigenschappen van HSbF6 te beschrijven.
Smeltpunt van fluorantimoonzuur:
HSbF6 heeft geen goed gedefinieerd smeltpunt vanwege zijn zeer reactieve karakter. Het kan alleen in vloeibare toestand voorkomen en breekt snel af bij afkoeling tot lagere temperaturen. Geschat wordt dat het rond -90°C ontleedt, waarbij giftige dampen van waterstoffluoride en antimoonpentafluoride vrijkomen.
Dichtheid van fluorantimoonzuur g/ml:
De dichtheid van HSbF6 is 2,1 g/ml. Deze hoge dichtheid kan worden toegeschreven aan de aanwezigheid van zware antimoonatomen in de moleculaire structuur. Het is een zeer corrosieve en reactieve verbinding en moet met uiterste voorzichtigheid worden gehanteerd. De dichtheid van HSbF6 maakt het ook moeilijk om het in het laboratorium te hanteren.
Molecuulgewicht van fluorantimoonzuur:
Het molecuulgewicht van fluorantimoonzuur is 236,76 g/mol. Het bestaat uit één waterstofion, één antimoonion en zes fluoride-ionen. Het hoge molecuulgewicht van fluorantimoonzuur kan worden toegeschreven aan de aanwezigheid van het zware antimoonatoom in zijn moleculaire structuur.
Formule van fluorantimonzuur:
De chemische formule voor fluorantimoonzuur is H[SbF6]. Het is samengesteld uit een waterstofion (H+) en een hexafluorantimonaat (V)-ion ([SbF6]^-). Het [SbF6]^- ion wordt gevormd door de reactie van antimoonpentafluoride (SbF5) met waterstoffluoride (HF). De formule vertegenwoordigt de eenvoudigste gehele getalsverhouding van de atomen die in de verbinding aanwezig zijn.
| Verschijning | Kleurloze tot lichtgele vloeistof |
| Soortelijk gewicht | 2,1 g/ml |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Geurloos |
| Molaire massa | 236,76 g/mol |
| Dikte | 2,1 g/ml |
| Fusie punt | Ontleedt rond -90°C |
| Kookpunt | Ontleedt boven -10°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert hevig met water |
| Oplosbaarheid | Oplosbaar in watervrij HF, SbF5, SO2F2 en SO2ClF |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | -21 (Hammett-zuurgraadfunctie) |
| pH | Minder dan -14 |
Opmerking: Fluorantimoonzuur is een zeer reactieve en bijtende verbinding waarmee uiterst voorzichtig moet worden omgegaan. De fysische en chemische eigenschappen ervan zijn moeilijk nauwkeurig te meten vanwege de onstabiele aard ervan en de beperkte beschikbare methoden voor manipulatie. De waarden in deze tabel zijn schattingen op basis van de beschikbare literatuur en zijn mogelijk niet nauwkeurig.
Veiligheid en gevaren van fluorantimonzuur
Fluorantimonzuur is een uiterst gevaarlijke en zeer bijtende stof die aanzienlijke gezondheids- en veiligheidsrisico’s met zich meebrengt. Het is een krachtig oxidatiemiddel dat heftig kan reageren met water, organische verbindingen en zelfs sommige metalen. Het kan ernstige brandwonden en weefselschade veroorzaken bij contact met de huid of ogen, en het inademen van de dampen kan ademhalingsproblemen en longschade veroorzaken.
Opgeleid personeel moet fluorantimoonzuur hanteren met behulp van gespecialiseerde apparatuur en beschermende kleding in goed geventileerde en goed uitgeruste laboratoria. Regelgevende instanties reguleren en beperken het gebruik van fluorantimoonzuur strikt vanwege het potentieel ervan om ernstig letsel en milieuschade te veroorzaken.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Adem geen dampen in. Draag handschoenen, kleding en oog-/gezichtsbescherming. Vermijd contact met huid, ogen en kleding. Alleen gebruiken onder een chemische kap. |
| VN-identificatienummers | UN3264 |
| HS-code | 28111990 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | Zeer giftig en bijtend; kan ernstige brandwonden en weefselschade veroorzaken bij contact met de huid of ogen, en het inademen van de dampen kan ademhalingsproblemen en longschade veroorzaken. |
Methoden voor de synthese van fluorantimoonzuur
Fluorantimoonzuur (HSbF6) wordt gewoonlijk gesynthetiseerd door waterstoffluoride (HF) en antimoonpentafluoride (SbF5) te mengen in een molaire verhouding van 1:1. De reactie vindt plaats onder watervrije omstandigheden en bij lage temperaturen om ontleding van het resulterende superzuur te voorkomen. De totale reactie kan als volgt worden weergegeven:
HF + SbF5 → HSbF6
De reactie is zeer exotherm en er kan een grote hoeveelheid warmte vrijkomen. Daarom wordt dit meestal uitgevoerd in een goed geventileerde en gecontroleerde omgeving, zoals een zuurkast, met gebruikmaking van passende beschermende maatregelen.
Om HSbF6 te bereiden, kan antimoontrifluoride (SbF3) in reactie worden gebracht met HF in aanwezigheid van een oxidatiemiddel zoals SbF5 of zwaveldioxidedifluoride (SO2F2). Deze reactie vereist watervrije omstandigheden en lage temperaturen. De reactie kan als volgt worden uitgedrukt:
SbF3 + 3HF + SO2F2 → HSbF6 + SO2
HSbF6 is een zeer reactieve en onstabiele verbinding die speciale behandeling en opslag vereist. Het wordt meestal opgeslagen in afgesloten, luchtdichte containers onder watervrije omstandigheden en bij lage temperaturen om ontleding te voorkomen. Goede veiligheidsmaatregelen en beschermende uitrusting zijn essentieel bij het werken met HSbF6 vanwege de hoge toxiciteit en corrosiviteit ervan.
Gebruik van fluorantimonzuur
Fluorantimoonzuur (HSbF6) is een van de krachtigste bekende superzuren en heeft een breed scala aan industriële en onderzoekstoepassingen. Hier zijn enkele toepassingen van fluorantimoonzuur:
- HSbF6 dient als katalysator bij verschillende chemische reacties, waaronder alkyleringen, isomerisaties en polymerisaties.
- De petrochemische industrie gebruikt HSbF6 bij de productie van benzine en andere koolwaterstoffen met een hoog octaangehalte.
- Onderzoekers in de farmaceutische industrie gebruiken HSbF6 als katalysator bij de synthese van verschillende farmaceutische producten, waaronder antivirale en kankerbestrijdende medicijnen.
- HSbF6 vindt toepassing bij het etsen en reinigen van elektronische componenten, zoals microchips en halfgeleiders, die worden gebruikt bij de productie van elektronische componenten.
- Wetenschappers gebruiken HSbF6 als onderzoeksinstrument op verschillende gebieden van de chemie en materiaalkunde, waaronder de synthese van nieuwe materialen en de studie van chemische reacties.
HSbF6 is een zeer reactieve en gevaarlijke stof die gespecialiseerde behandelings- en beschermende maatregelen vereist. Het is strikt gereguleerd en mag alleen worden gebruikt door opgeleid personeel in goed uitgeruste laboratoria. De potentiële gevaren die met HSbF6 gepaard gaan, beperken het gebruik ervan tot gespecialiseerde toepassingen waarvoor geen andere alternatieven beschikbaar zijn.
Vragen:
Kan fluorantimoonzuur diamant oplossen?
HSbF6 kan diamant oplossen vanwege zijn sterk zure eigenschappen. Opgeleide professionals in goed uitgeruste laboratoria met passende veiligheidsmaatregelen en beschermende uitrusting kunnen de zeer gevaarlijke reactie tussen diamant en HSbF6 uitvoeren. Het is echter geen praktische of kosteneffectieve methode voor het bewerken of snijden van diamant. Mechanisch snijden of lasersnijden worden veel vaker gebruikt vanwege hun efficiëntie en veiligheid.
Waar fluorantimoonzuur kopen?
Het kopen van HSbF6 is uiterst moeilijk vanwege het zeer gevaarlijke en gereguleerde karakter ervan. Alleen erkende en geautoriseerde bedrijven of instellingen met de benodigde vergunningen en apparatuur kunnen zuur veilig hanteren en opslaan.
De Chemical Weapons Convention (CWC) en de Amerikaanse Chemical Facilities Anti-Terrorism Standards (CFATS)-voorschriften classificeren HSbF6 als een gevaarlijke en gereguleerde stof.
Overheidsinstanties zoals de Environmental Protection Agency (EPA), het Department of Homeland Security (DHS) en het Bureau of Industry and Security (BIS) reguleren en controleren de verkoop en aankoop van HSbF6 strikt.
Als u een legitieme behoefte heeft aan HSbF6, kunt u contact opnemen met erkende chemische leveranciers of onderzoeksinstituten met de benodigde vergunningen en expertise.
U moet echter een gedetailleerde motivering geven en de benodigde goedkeuringen en vergunningen verkrijgen voordat u een aankoop doet.
