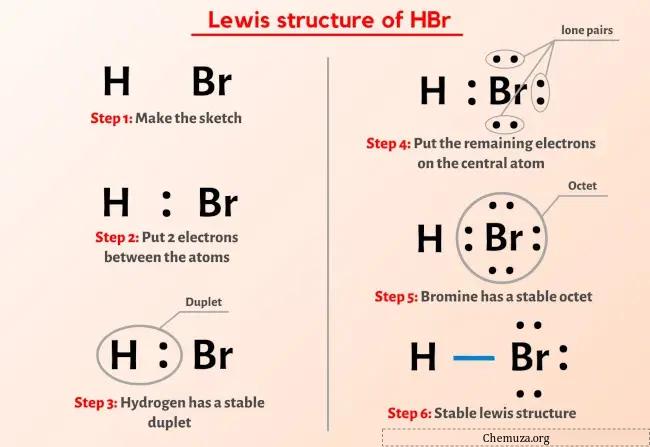
Dus je hebt de afbeelding hierboven al gezien, toch?
Ik zal het bovenstaande beeld kort toelichten.
De HBr (waterstofbromide) Lewis-structuur heeft een waterstofatoom (H) en een broomatoom (Br) dat een enkele binding daartussen bevat. Er zijn 3 alleenstaande paren op het broomatoom (Br).
Als je niets hebt begrepen van de bovenstaande afbeelding van de Lewis-structuur van HBr (waterstofbromide), blijf dan bij mij en je krijgt de gedetailleerde stapsgewijze uitleg over het tekenen van een structuur van Lewis van HBr .
Laten we dus verder gaan met de stappen voor het tekenen van de Lewis-structuur van HBr.
Stappen voor het tekenen van de HBr Lewis-structuur
Stap 1: Zoek het totale aantal valentie-elektronen in het HBr-molecuul
Om het totale aantal valentie-elektronen in het HBr-molecuul (waterstofbromide) te vinden, moet je eerst de valentie-elektronen kennen die aanwezig zijn in een enkel waterstofatoom en in het broomatoom.
(Valentie-elektronen zijn de elektronen die aanwezig zijn in de buitenste baan van elk atoom.)
Hier zal ik je vertellen hoe je gemakkelijk de valentie-elektronen van waterstof en broom kunt vinden met behulp van een periodiek systeem .
Totale valentie-elektronen in het HBr-molecuul
→ Valentie-elektronen gegeven door het waterstofatoom:
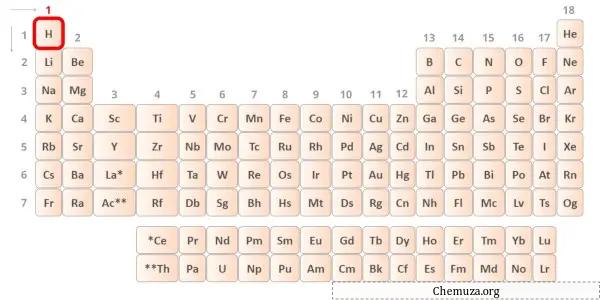
Waterstof is een element uit groep 1 van het periodiek systeem.[1] Het valentie-elektron in waterstof is dus 1 .

Je kunt zien dat er slechts één valentie-elektron aanwezig is in het waterstofatoom, zoals weergegeven in de afbeelding hierboven.
→ Valentie-elektronen gegeven door het broomatoom:
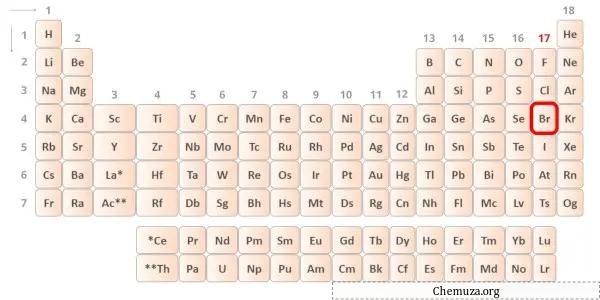
Broom is een element in groep 17 van het periodiek systeem. [2] Daarom zijn de valentie-elektronen in broom 7 .
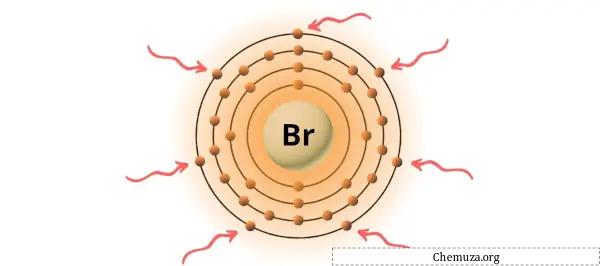
Je kunt de 7 valentie-elektronen zien die aanwezig zijn in het broomatoom, zoals weergegeven in de afbeelding hierboven.
Dus,
Totale valentie-elektronen in HBr-molecuul = valentie-elektronen gedoneerd door 1 waterstofatoom + valentie-elektronen gedoneerd door 1 broomatoom = 1 + 7 = 8 .
Stap 2: Selecteer het centrale atoom
Om het centrale atoom te selecteren, moeten we onthouden dat het minst elektronegatieve atoom in het centrum blijft.
Het gegeven molecuul is nu HBr (waterstofbromide). Het heeft slechts twee atomen, dus je kunt elk ervan als centraal atoom selecteren.

Laten we aannemen dat het broomatoom een centraal atoom is (omdat we waterstof in elke Lewis-structuur buiten moeten houden).
Stap 3: Verbind elk atoom door er een paar elektronen tussen te plaatsen
Nu moet je in het HBr-molecuul de elektronenparen tussen het waterstofatoom (H) en het broomatoom (Br) plaatsen.

Dit geeft aan dat het waterstofatoom (H) en het broomatoom (Br) chemisch aan elkaar gebonden zijn in een HBr-molecuul.
Stap 4: Maak de externe atomen stabiel. Plaats het resterende valentie-elektronenpaar op het centrale atoom.
In deze stap moet je de stabiliteit van het externe atoom controleren.
Hier in het diagram van het HBr-molecuul gingen we ervan uit dat het broomatoom het centrale atoom was. Waterstof is dus het externe atoom.
We moeten het waterstofatoom daarom stabiel maken.
Je ziet in onderstaande afbeelding dat het waterstofatoom een duplet vormt en dus stabiel is.
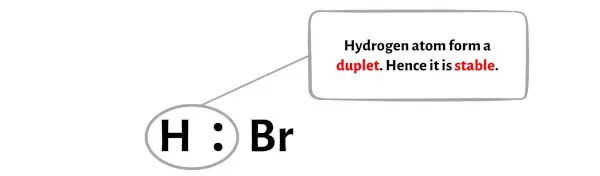
Bovendien hebben we in stap 1 het totale aantal valentie-elektronen berekend dat aanwezig is in het HBr-molecuul.
Het HBr-molecuul heeft in totaal 8 valentie-elektronen en hiervan worden in het bovenstaande diagram slechts 2 valentie-elektronen gebruikt.
Dus het aantal resterende elektronen = 8 – 2 = 6 .
Je moet deze 6 elektronen op het broomatoom in het bovenstaande diagram van het HBr-molecuul plaatsen.
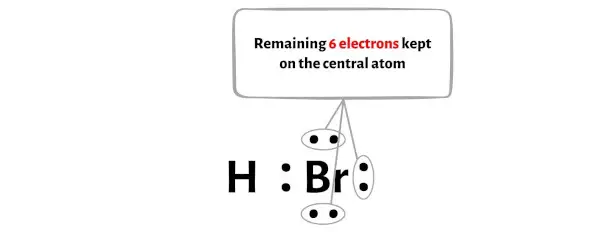
Laten we nu verder gaan met de volgende stap.
Stap 5: Controleer het octet op het centrale atoom
In deze stap moet u controleren of het centrale broomatoom (Br) stabiel is of niet.
Om de stabiliteit van het centrale broomatoom (Br) te controleren, moeten we controleren of het een octet vormt of niet.
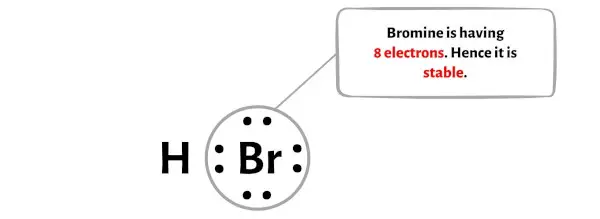
Je kunt in de afbeelding hierboven zien dat het broomatoom een octet vormt. Dit betekent dat het 8 elektronen heeft.
En dus is het centrale broomatoom stabiel.
Laten we nu verder gaan met de laatste stap om te controleren of de Lewis-structuur van HBr stabiel is of niet.
Stap 6: Controleer de stabiliteit van de Lewis-structuur
Nu ben je bij de laatste stap gekomen waarin je de stabiliteit van de Lewis-structuur van HBr moet controleren.
De stabiliteit van de Lewis-structuur kan worden geverifieerd met behulp van een formeel ladingsconcept .
Kortom, we moeten nu de formele lading vinden van de waterstofatomen (H) en van de broomatomen (Br) die aanwezig zijn in het HBr-molecuul.
Om de formele belasting te berekenen, moet u de volgende formule gebruiken:
Formele lading = Valentie-elektronen – (bindende elektronen)/2 – Niet-bindende elektronen
In de onderstaande afbeelding ziet u het aantal bindende elektronen en niet-bindende elektronen voor elk atoom van het HBr-molecuul.
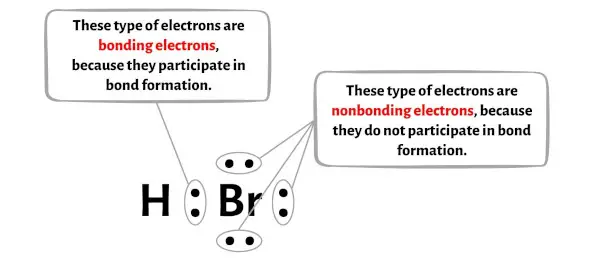
Voor het waterstofatoom (H):
Valentie-elektron = 1 (omdat waterstof in groep 1 zit)
Bindende elektronen = 2
Niet-bindende elektronen = 0
Voor het broomatoom (Br):
Valentie-elektron = 7 (omdat broom in groep 17 zit)
Bindende elektronen = 2
Niet-bindende elektronen = 6
| Formele beschuldiging | = | valentie-elektronen | – | (Bindende elektronen)/2 | – | Niet-bindende elektronen | ||
| H | = | 1 | – | 2/2 | – | 0 | = | 0 |
| Br | = | 7 | – | 2/2 | – | 6 | = | 0 |
Uit de bovenstaande formele ladingsberekeningen kun je zien dat zowel het waterstofatoom (H) als het broomatoom (Br) een formele lading “nul” hebben.
Dit geeft aan dat de bovenstaande Lewis-structuur van HBr stabiel is en dat er geen verandering meer is in de bovenstaande structuur van HBr.
In de bovenstaande Lewis-puntenstructuur van HBr kun je elk paar bindende elektronen (:) ook voorstellen als een enkele binding (|). Als u dit doet, ontstaat de volgende Lewis-structuur van HBr.
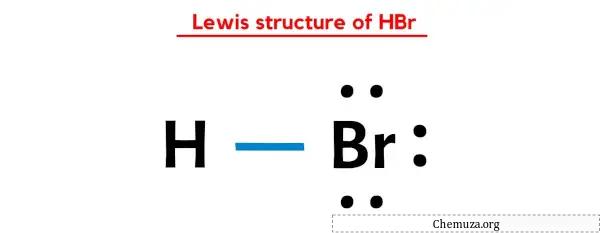
Ik hoop dat je alle bovenstaande stappen volledig hebt begrepen.
Voor meer oefening en een beter begrip kun je andere Lewis-structuren proberen die hieronder worden vermeld.
Probeer (of bekijk in ieder geval) deze Lewis-structuren voor een beter begrip:
