Goudchloride (AuCl3) is een verbinding die wordt gevormd door goud met chloor te combineren. Het wordt gebruikt in een verscheidenheid aan toepassingen, waaronder vergulden en als katalysator bij chemische reacties.
| IUPAC-naam | Goud(III)chloride |
| Moleculaire formule | AuCl3 |
| CAS-nummer | 13453-07-1 |
| Synoniemen | Aurinechloride, Trichloorgoud, Goudtrichloride |
| InChi | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Eigenschappen van goudchloride
Goudchloride-formule
De formule voor goudtrichloride is AuCl3. Het is een chemische verbinding bestaande uit één goudatoom (Au) en drie chlooratomen (Cl). Deze formule vertegenwoordigt de stoichiometrie van de elementen die aanwezig zijn in goudtrichloride.
Molaire massa van goudchloride
De molaire massa van goudtrichloride wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Voor goudtrichloride (AuCl3) bedraagt de molaire massa ongeveer 303,33 g/mol. Het is nuttig voor het bepalen van de hoeveelheid stof in een bepaald monster.
Kookpunt van goudchloride
Goudtrichloride heeft een kookpunt van ongeveer 254°C (graden Celsius). Bij deze temperatuur verandert de verbinding van vloeibare naar gasvormige toestand. Het kookpunt geeft de temperatuur aan waarbij de dampspanning van de vloeistof gelijk is aan de atmosferische druk.
Smeltpunt van goudchloride
Het smeltpunt van goudtrichloride is ongeveer 254°C (graden Celsius). Dit is de temperatuur waarbij de vaste vorm van de verbinding in een vloeistof verandert. Het begrijpen van het smeltpunt is essentieel in verschillende industriële processen.
Dichtheid van goudchloride g/ml
De dichtheid van goudtrichloride is ongeveer 4,7 g/ml (gram per milliliter). Dichtheid is de maatstaf voor de massa per volume-eenheid van een stof. De relatief hoge dichtheid van goudtrichloride maakt het zwaarder dan water.
Goudchloride Molecuulgewicht
Het molecuulgewicht van goudtrichloride, ook bekend als molaire massa, is ongeveer 303,33 g/mol (gram per mol). Het is de som van de atoomgewichten van alle atomen in de verbinding. Molecuulgewicht is cruciaal bij chemische berekeningen.
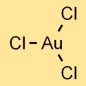
Structuur van goudchloride
Goudtrichloride (AuCl3) heeft een moleculaire structuur bestaande uit één goudatoom gebonden aan drie chlooratomen. De opstelling vormt een trigonale vlakke vorm, met het goudatoom in het midden en de chlooratomen eromheen.
Oplosbaarheid van goudchloride
Goudtrichloride heeft een beperkte oplosbaarheid in water. Het lost beter op in bepaalde organische oplosmiddelen, zoals ethanol en chloroform. De oplosbaarheid van goudtrichloride wordt beïnvloed door factoren zoals temperatuur en de aard van het oplosmiddel.
| Verschijning | Gele vaste stof |
| Soortelijk gewicht | ~4,7 g/ml |
| Kleur | GEEL |
| Geur | Geurloos |
| Molaire massa | ~303,33 g/mol |
| Dikte | ~4,7 g/ml |
| Fusie punt | ~254°C |
| Kookpunt | ~254°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Beperkte oplosbaarheid |
| Oplosbaarheid | Oplosbaar in sommige organische oplosmiddelen zoals ethanol en chloroform |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Neutraal (pH 7) |
Veiligheid en gevaren van goudchloride
Goudtrichloride brengt potentiële veiligheidsrisico’s met zich mee en vereist een zorgvuldige omgang. Het is essentieel om geschikte beschermende uitrusting te dragen, zoals handschoenen en een veiligheidsbril, om huidcontact en oogirritatie te voorkomen. Inademing van stof of damp moet worden vermeden vanwege mogelijke ademhalingsproblemen. Bovendien kan blootstelling aan hoge temperaturen resulteren in het vrijkomen van giftig chloorgas. De verbinding is ook onverenigbaar met sterke reductiemiddelen, wat tot gevaarlijke reacties kan leiden. Passende maatregelen voor opslag, etikettering en insluiting zijn noodzakelijk om ongelukken te voorkomen. Het begrijpen van deze gevaren en veiligheidsmaatregelen is van cruciaal belang bij het werken met goudtrichloride in een laboratorium of industriële omgeving.
| Gevarensymbolen | Gevaar |
| Beveiligingsbeschrijving | Breekbaar. Vermijd contact met huid en ogen. Adem geen stof of dampen in. Verwijderd houden van sterke reductiemiddelen. |
| VN-identificatienummers | Niet beschikbaar |
| HS-code | 2843.29 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig bij inslikken of inademen. Kan huid- en oogirritatie veroorzaken. |
Methoden voor de synthese van goudchloride
Verschillende methoden maken de synthese van goudtrichloride mogelijk.
Een gebruikelijke aanpak is om goud of goudoxide op te lossen in zoutzuur (HCl) . Bij de reactie ontstaan goudtrichloride en water. Een andere methode is het laten reageren van goud met chloorgas, waarbij direct goudtrichloride wordt gevormd. Als alternatief kan chloorgas reageren met metallisch goud in aanwezigheid van een katalysator zoals ijzerchloride, waarbij goudtrichloride en ijzerchloride als bijproducten worden geproduceerd.
Een andere syntheseroute omvat het laten reageren van metallisch goud met koningswater, een mengsel van geconcentreerd salpeterzuur (HNO3) en zoutzuur . De krachtige oxiderende eigenschappen van Aqua regia zetten goud om in goudtrichloride, dat door verdamping kan worden geïsoleerd. Goudtrichloride wordt gevormd wanneer zoutzuur reageert met goud(III)oxide (Au2O3), waarbij goudtrichloride en water ontstaan.
Verschillende reductiemiddelen, zoals tin(II)chloride (SnCl2) of zwaveldioxide (SO2), kunnen goud(V)chloride (AuCl5) actief reduceren om goudtrichloride te synthetiseren. Bij de reactie ontstaan goudtrichloride en het chloride van het overeenkomstige reductiemiddel.
Elke methode heeft zijn voordelen en toepasbaarheid, afhankelijk van de beschikbare grondstoffen en de gewenste zuiverheid van het goudtrichloride. Een zorgvuldige afweging van de reactieomstandigheden en veiligheidsmaatregelen is cruciaal tijdens het syntheseproces.
Gebruik van goudchloride
Goudtrichloride vindt verschillende toepassingen vanwege zijn unieke eigenschappen:
- Vergulden: Goudtrichloride dient als bron van goudionen voor galvaniseerprocessen, waardoor een dunne laag goud op oppervlakken kan worden afgezet. Dit verbetert de geleidbaarheid en zorgt voor een aantrekkelijke, corrosiebestendige afwerking.
- Katalysator: Goudtrichloride fungeert als katalysator bij verschillende chemische reacties, vooral bij de organische synthese. Het vermogen om bepaalde verbindingen te activeren maakt het waardevol voor het bevorderen van specifieke reacties.
- Geneeskunde: Onderzoekers hebben goudtrichlorideverbindingen onderzocht voor potentiële therapeutische toepassingen bij de behandeling van artritis en andere ontstekingsziekten.
- Fotografie: In de fotografie wordt goudtrichloride gebruikt als toner, waardoor zwart-witafdrukken paarse en bruine kleuren krijgen.
- Glas en keramiek: De glasindustrie gebruikt goudtrichloride om robijnglas te produceren, waardoor het een rode kleur krijgt, en keramiek profiteert van het gebruik ervan om de kleur te versterken.
- Nanotechnologie: Goudtrichloride speelt een cruciale rol in de nanotechnologie door de synthese van gouden nanodeeltjes te vergemakkelijken, die toepassingen hebben in de elektronica, katalyse en medische beeldvorming.
- Antibacterieel middel: Nanodeeltjes van goudtrichloride zijn veelbelovend als antibacterieel middel, waardoor de groei van bepaalde bacteriën effectief wordt geremd.
- Kunstbehoud: Bij kunstrestauratie gebruiken experts goudtrichloride om historische pigmenten te vergulden en opnieuw te creëren.
- Laboratoriumreagens: Wetenschappers gebruiken het als laboratoriumreagens voor verschillende chemische analyses en onderzoeksdoeleinden.
- Metallic inkten: Fabrikanten gebruiken goudtrichloride-inkten voor printdoeleinden, waardoor een vleugje luxe wordt toegevoegd aan producten zoals briefpapier en verpakkingen.
Vanwege zijn veelzijdigheid en unieke eigenschappen blijft goudtrichloride relevant in verschillende industrieën en speelt het een belangrijke rol in technologie, kunst, geneeskunde en materiaalkunde.
Vragen:
Vraag: Welke chemische stof kan ik gebruiken om goud uit goudchloride te laten neerslaan?
A: Natriummetabisulfiet (Na2S2O5) kan worden gebruikt als reductiemiddel om goud uit goudtrichloride-oplossingen te laten neerslaan.
Vraag: Zit er mono-atomair goud in goudchloride?
A: Nee, mono-atomair goud is geen goudtrichloride; het is een aparte vorm van goud dat bestaat uit individuele atomen, niet in een samengestelde staat.
Vraag: Wat is de molaire massa van goud III-chloride?
A: De molaire massa van goudtrichloride III (AuCl3) is ongeveer 303,33 g/mol.
Vraag: Wat is goudchloride?
A: Goudtrichloride (AuCl3) is een chemische verbinding die wordt gevormd door goud te combineren met chloor en wordt gebruikt in verschillende toepassingen zoals vergulden en katalyse.
Vraag: Hoe kan ik tin(II)chloride maken om op goud te testen?
A: Stannochloride (SnCl2) kan worden bereid door metallisch tin op te lossen in zoutzuur (HCl), gevolgd door reductie.
Vraag: Wat is de molaire massa van AuCl3?
A: De molaire massa van AuCl3 (goud III-trichloride) is ongeveer 303,33 g/mol.
Vraag: Wat is het percentage goud in AuCl3?
A: Het percentage goud in AuCl3 is ongeveer 42,49%.
Vraag: Hoeveel mol H2O zit er in 3,4 g AuCl3 · 2 H2O?
A: Er zit 0,0349 mol H2O in 3,4 g AuCl3 · 2 H2O.
Vraag: Is AuCl3 oplosbaar in water?
A: Ja, AuCl3 (goud III-trichloride) is tot op zekere hoogte oplosbaar in water.
Vraag: Hoeveel gram goud kan worden teruggewonnen uit 35 g AuCl3?
A: Uit 35 g AuCl3 kan ongeveer 14,87 gram goud worden gewonnen.
Vraag: Wat is de molaire oplosbaarheid van AuCl3? Ksp = 3,2 × 10−25
A: De molaire oplosbaarheid van AuCl3, gegeven Ksp = 3,2 × 10−25, is ongeveer 1,8 × 10^-9 mol/L.
