Ftaalzuur is een organische verbinding. Het wordt gebruikt bij de productie van kleurstoffen, kunststoffen en harsen. Het heeft carbonzuurgroepen en aromatische ringen.
| IUPAC-naam | Benzeen-1,2-dicarbonzuur |
| Moleculaire formule | C8H6O4 |
| CAS-nummer | 88-99-3 |
| Synoniemen | 1,2-benzeendicarbonzuur, orthoftaalzuur, O-ftaalzuur, PA, 1,2-ftaalzuur |
| InChi | InChI=1S/C8H6O4/c9-7(10)5-3-1-2-4-6(5)8(11)12/h1-4H,(H,9,10)(H,11,12) |
Eigenschappen van ftaalzuur
Ftaalzuurformule
De chemische formule voor orthoftaalzuur is C8H6O4. Het bestaat uit acht koolstofatomen, zes waterstofatomen en vier zuurstofatomen. De formule vertegenwoordigt de samenstelling van orthoftaalzuur op moleculair niveau.
Ftaalzuur molaire massa
De molaire massa van orthoftaalzuur wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Orthoftaalzuur heeft een molaire massa van ongeveer 166,13 gram per mol. Het is afgeleid van de som van de atoommassa’s van de koolstof-, waterstof- en zuurstofatomen van de verbinding.
Kookpunt van ftaalzuur
Orthoftaalzuur heeft een kookpunt van ongeveer 295 graden Celsius (563 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop de vloeibare vorm van orthoftaalzuur onder standaard atmosferische druk overgaat in de gasvormige toestand.
Ftaalzuur Smeltpunt
Het smeltpunt van orthoftaalzuur ligt rond de 230 graden Celsius (446 graden Fahrenheit). Het geeft de temperatuur aan waarbij de vaste vorm van orthoftaalzuur overgaat in een vloeibare toestand.
Ftaalzuurdichtheid g/ml
De dichtheid van orthoftaalzuur is doorgaans ongeveer 1,59 gram per milliliter. Dichtheid vertegenwoordigt de massa van een stof per volume-eenheid en geeft informatie over de compactheid van het materiaal.
Ftaalzuur Molecuulgewicht
Het molecuulgewicht van orthoftaalzuur is ongeveer 166,13 gram per mol. Het betekent de som van de atoomgewichten van alle atomen die aanwezig zijn in een molecuul van de verbinding.
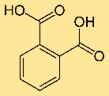
Structuur van ftaalzuur
Orthoftaalzuur heeft een moleculaire structuur die bestaat uit een benzeenring met twee carbonzuurgroepen bevestigd aan aangrenzende koolstofatomen. Deze structuur geeft het zijn karakteristieke eigenschappen en zijn reactiviteit in verschillende chemische reacties.
Oplosbaarheid van ftaalzuur
Orthoftaalzuur heeft een matige oplosbaarheid in water. Het lost gemakkelijker op in organische oplosmiddelen zoals ethanol, methanol en aceton. De oplosbaarheid van orthoftaalzuur wordt beïnvloed door factoren zoals temperatuur, pH en de aard van het gebruikte oplosmiddel.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1.593 g/cm³ |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 166,13 g/mol |
| Dikte | 1,59 g/ml |
| Fusie punt | 230°C |
| Kookpunt | 295°C |
| Flitspunt | 156°C |
| oplosbaarheid in water | 1,7 g/l |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ethanol, methanol en aceton |
| Dampdruk | 0,01 mmHg bij 25°C |
| Dampdichtheid | 5,75 (lucht = 1) |
| pKa | 2,89 |
| pH | 2,0 – 3,0 |
Veiligheid en gevaren van ftaalzuur
Orthoftaalzuur brengt enkele veiligheidsrisico’s met zich mee waarmee rekening moet worden gehouden. Bij direct contact kan het huid- en oogirritatie veroorzaken. Inademing van stof of dampen kan de luchtwegen irriteren. Bij het hanteren van deze verbinding moeten beschermende maatregelen, zoals handschoenen en een veiligheidsbril, worden gedragen. Het is ook belangrijk om in een goed geventileerde ruimte te werken om blootstelling te minimaliseren. Inname van orthoftaalzuur kan schadelijk zijn en moet worden vermeden. Bovendien is het raadzaam om orthoftaalzuur op te slaan en te hanteren volgens de toepasselijke veiligheidsprotocollen en -voorschriften om ongelukken of onbedoelde blootstelling te voorkomen.
| Gevarensymbolen | Xn (schadelijk) |
| Beveiligingsbeschrijving | Vermijd contact met huid/ogen |
| VN-identificatienummers | VN 3077 |
| HS-code | 2917.36.0000 |
| Gevarenklasse | 9 (Diverse gevaarlijke materialen en voorwerpen) |
| Verpakkingsgroep | III (laag gevaar) |
| Toxiciteit | Matig giftig |
Ftaalzuursynthesemethoden
Verschillende methoden kunnen orthoftaalzuur synthetiseren.
Een veelgebruikte methode omvat de oxidatie van naftaleen, een koolwaterstof afgeleid van koolteer of aardolie. Bij dit proces ondergaat naftaleen gecontroleerde oxidatie met behulp van lucht of zuurstof in aanwezigheid van een katalysator, zoals vanadiumpentoxide of kobaltacetaat. Hydrolyse zet het resulterende product om in orthoftaalzuur.
De oxidatie van orthoxyleen, afgeleid van xyleen verkregen uit aardolie, maakt de synthese van ftaalzuuranhydride mogelijk. Dit proces omvat het oxideren van orthoxyleen met lucht of zuurstof in aanwezigheid van een katalysator, meestal een gemengd metaaloxide. Vervolgens vormt de hydrolyse van ftaalzuuranhydride orthoftaalzuur.
Om orthoftaalzuur te synthetiseren, kan men de carbonylering van ftaalzuuranhydride gebruiken, met behulp van koolmonoxide en een katalysator zoals rhodium of iridium. Deze reactie resulteert in de vorming van orthoftaalzuur.
Over het geheel genomen maken deze synthesemethoden de productie van orthoftaalzuur op grote schaal mogelijk. Het is echter belangrijk op te merken dat specifieke reactieomstandigheden, katalysatoren en zuiveringsprocessen kunnen variëren afhankelijk van de gewenste zuiverheid en toepassing van het geproduceerde orthoftaalzuur.
Gebruik van ftaalzuur
Orthoftaalzuur vindt toepassing in verschillende industrieën vanwege zijn veelzijdige eigenschappen. Hier zijn enkele van de meest voorkomende toepassingen:
- Kleurstofproductie: Bij de productie van kleurstoffen, met name op ftaleïne gebaseerde kleurstoffen, wordt orthoftaalzuur als voorloper gebruikt. Industrieën zoals textiel, drukwerk en schilderkunst gebruiken deze kleurstoffen.
- Weekmakers: Orthoftaalzuur speelt een sleutelrol bij de productie van weekmakers, met name ftaalzuuresters. Fabrikanten voegen weekmakers toe aan kunststoffen om de flexibiliteit, duurzaamheid en verwerkbaarheid te verbeteren. PVC-producten zoals kabels, vloerbedekking en bekleding bevatten voor een groot deel weekmakers.
- Harsproductie: Orthoftaalzuur fungeert als bouwsteen voor de productie van alkydharsen, die veel worden gebruikt in coatings, vernissen en lijmen. Deze harsen bieden uitstekende duurzaamheid, glans en chemische bestendigheid.
- Farmaceutische synthese: Orthoftaalzuur dient als tussenproduct bij de synthese van verschillende farmaceutische verbindingen. Het dient als grondstof voor de productie van medicijnen, waaronder antihistaminica en diuretica.
- Laboratoriumreagens: Onderzoekers gebruiken orthoftaalzuur als reagens in laboratoriumexperimenten, vooral bij organische synthese. Het maakt de introductie van carbonzuurgroepen in organische verbindingen mogelijk.
- Chemische tussenproducten: Derivaten van orthoftaalzuur functioneren als tussenproducten bij de synthese van andere chemicaliën. Deze derivaten ondergaan verdere reacties om verbindingen zoals ftalimide, ftalonitril en ftaloylchloride te genereren.
- Corrosieremmers: Orthoftaalzuurverbindingen dienen als corrosieremmers in verschillende toepassingen. Ze helpen metalen oppervlakken te beschermen tegen corrosie en degradatie tijdens industriële processen.
De diversiteit aan toepassingen onderstreept het belang van orthoftaalzuur in meerdere industrieën, wat het belang ervan als veelzijdige chemische verbinding aantoont.
Vragen:
Vraag: Hoeveel ml kokend water is er nodig om 25 g ftaalzuur op te lossen?
A: Het exacte volume hangt af van de oplosbaarheid, maar er is ongeveer 150 ml kokend water nodig om 25 g orthoftaalzuur op te lossen.
Vraag: Hoe ruikt ftaalzuur?
A: Orthoftaalzuur is geurloos.
Vraag: Wat is het kookpunt van ftaalzuur?
A: Het kookpunt van orthoftaalzuur is ongeveer 295°C.
Vraag: Hoeveel gram ftaalzuur zou herkristalliseren?
A: De hoeveelheid orthoftaalzuur die herkristalliseert, hangt af van factoren zoals de afkoelsnelheid en de aanwezige onzuiverheden, en varieert dus.
Vraag: Waar wordt ftaalzuur voor gebruikt?
A: Orthoftaalzuur wordt gebruikt bij de productie van kleurstoffen, kunststoffen, harsen, farmaceutische producten en als laboratoriumreagens.
Vraag: Hoe bepaal ik hoeveel water er nodig is om ftaalzuur op te lossen?
A: Het water dat nodig is voor het oplossen hangt af van de oplosbaarheid van het orthoftaalzuur, wat kan worden bepaald op basis van experimentele gegevens of literatuurreferenties.
Vraag: Wat zijn de “functionele groepen” van ftaalzuur?
A: De functionele groepen van orthoftaalzuur zijn twee carbonzuurgroepen (-COOH) gebonden aan een aromatische ring.
Vraag: Is ftaalzuur oplosbaar?
A: Ja, orthoftaalzuur is matig oplosbaar in water en beter oplosbaar in organische oplosmiddelen.
Vraag: Wat zou het effect zijn als ftaalzuur zou worden gebruikt in plaats van KHP als de primaire standaard voor NaOH?
A: Het gebruik van orthoftaalzuur als de primaire standaard voor NaOH zou fouten introduceren bij de bepaling van de NaOH-concentratie als gevolg van verschillen in molecuulgewicht en stoichiometrie.
Vraag: Welke massa dikaliumftalaat moet aan ftaalzuur worden toegevoegd om een… buffer te verkrijgen?
A: De specifieke massa dikaliumftalaat die nodig is om een buffer te creëren, hangt af van de gewenste pH en de concentratie orthoftaalzuur.
