Fosgeen is een giftig gas dat wordt gebruikt in industriële processen en bij oorlogsvoering. Het inademen ervan brengt ernstige gezondheidsrisico’s met zich mee, veroorzaakt ademhalingsschade en kan dodelijk zijn.
| IUPAC-naam | Carbonyldichloride |
| Moleculaire formule | COCl2 |
| CAS-nummer | 75-44-5 |
| Synoniemen | Koolzuurdichloride, fosgeengas, carbonylchloride |
| InChi | InChI=1S/CCl2O/c2-1(3)4 |
Eigenschappen van fosgeen
Fosgeen formule
De chemische formule voor fosgeen of koolstofdichloride is COCl2. Het bestaat uit één koolstofatoom (C), één zuurstofatoom (O) en twee chlooratomen (Cl). Deze moleculaire samenstelling is essentieel voor het begrijpen van de eigenschappen en reacties ervan.
Fosgeen Molaire Massa
De molaire massa van koolstofdichloride is ongeveer 98,92 g/mol. Het wordt berekend door de atoommassa’s van de bestanddelen ervan op te tellen, namelijk koolstof (12,01 g/mol), zuurstof (16,00 g/mol) en chloor (elk 35,45 g/mol).
Kookpunt van fosgeen
Koolzuurdichloride heeft een relatief laag kookpunt van ongeveer -23,3°C (-9,94°F). Bij deze temperatuur verandert het van zijn vloeibare toestand naar een gasvormige toestand, wat cruciaal is voor de toepassing ervan in verschillende industriële processen.
Fosgeen smeltpunt
Het smeltpunt van kooldioxide is vrij laag, ongeveer -118,3°C (-180,94°F). Bij deze temperatuur verandert de vaste vorm van koolstofdichloride in een vloeistof. Het begrijpen van deze eigenschap is belangrijk voor het veilig omgaan met kooldichloride.
Fosgeendichtheid g/ml
Koolzuurdichloride heeft een dichtheid van ongeveer 1,432 g/ml bij kamertemperatuur (25°C of 77°F). Deze eigenschap is cruciaal bij het bepalen van het gedrag en de interacties met andere stoffen.
Fosgeen molecuulgewicht
Het molecuulgewicht van koolstofdichloride is 98,92 g/mol. Deze waarde is van vitaal belang voor verschillende berekeningen in de scheikunde, waaronder stoichiometrie en het bepalen van de hoeveelheid koolstofdichloride die nodig is voor reacties.
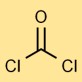
Structuur van fosgeen
Koolzuurdichloride heeft een lineaire moleculaire structuur, waarbij het koolstofatoom dubbel gebonden is aan het zuurstofatoom en enkelvoudig gebonden aan elk chlooratoom. Deze opstelling beïnvloedt het reactievermogen en de stabiliteit ervan.
Oplosbaarheid van fosgeen
Koolzuurdichloride is slecht oplosbaar in water, waarbij slechts een kleine hoeveelheid gas in de vloeistof oplost. Het kan echter met water reageren en zoutzuur en kooldioxide produceren, waardoor het gevaarlijk wordt in waterige omgevingen.
Het begrijpen van deze eigenschappen van koolzuurdichloride is essentieel voor het veilig hanteren en gebruiken van de chemische stof in industriële toepassingen en andere omgevingen. Bij de omgang met deze giftige en reactieve verbinding moeten altijd de juiste voorzorgsmaatregelen worden genomen om ongelukken en gevaren voor de gezondheid te voorkomen.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 3.428 (gas) |
| Kleur | N.v.t |
| Geur | Verstikkend, stekend |
| Molaire massa | 98,92 g/mol |
| Dikte | 1.432 g/ml (vloeistof) |
| Fusie punt | -118,3°C (-180,94°F) |
| Kookpunt | -23,3°C (-9,94°F) |
| Flitspunt | N.v.t |
| oplosbaarheid in water | Reageert met water |
| Oplosbaarheid | Reageert met water, waarbij zoutzuur en koolstofdioxide ontstaan |
| Dampdruk | 736 mmHg (25°C) |
| Dampdichtheid | 2,98 (lucht = 1) |
| pKa | N.v.t |
| pH | N.v.t |
Deze fysisch-chemische eigenschappen verschaffen essentiële informatie over koolstofdichloride, waardoor de veilige hantering ervan wordt vergemakkelijkt en het gedrag ervan in verschillende omgevingen wordt begrepen.
Veiligheid en gevaren van fosgeen
Koolzuurdichloride brengt aanzienlijke veiligheidsrisico’s met zich mee vanwege het toxische en reactieve karakter ervan. Draag bij het hanteren van kooldichloride geschikte persoonlijke beschermingsmiddelen (PBM), inclusief ademhalingsbescherming, handschoenen en oogbescherming. Zorg voor voldoende ventilatie in de werkruimten om blootstelling door inademing te voorkomen. Vermijd contact met huid en ogen, aangezien dit ernstige irritatie en brandwonden kan veroorzaken. Koolstofdichloridegas heeft geen geur, waardoor het moeilijk te detecteren is. Monitoringapparatuur is daarom van cruciaal belang. Bij blootstelling dient u onmiddellijk medische hulp in te roepen. Bewaar en transporteer kooldichloride veilig, volgens de regelgeving en best practices. Het begrijpen van de gevaren ervan is essentieel voor het voorkomen van ongelukken en het beschermen van zowel de menselijke gezondheid als het milieu.
| Gevarensymbolen | Schedel en gekruiste knekels |
| Beveiligingsbeschrijving | Zeer giftig gas. Ga uiterst voorzichtig te werk. Gebruik geschikte PBM’s. Vermijd inademing en contact met de huid. |
| VN-identificatienummers | UN1076 |
| HS-code | 2812.10.0000 |
| Gevarenklasse | 2.3 (giftig gas) |
| Verpakkingsgroep | I |
| Toxiciteit | Fosgeen is zeer giftig en kan dodelijk zijn bij inademing of contact met de huid. Gebruik strikte veiligheidsmaatregelen. |
Het begrijpen van de risico- en veiligheidsaspecten van kooldichloride is van cruciaal belang voor een veilige omgang en het voorkomen van ongevallen. Het is zeer giftig en brengt aanzienlijke gezondheidsrisico’s met zich mee, waardoor goede veiligheidsprocedures en voorzorgsmaatregelen essentieel zijn.
Fosgeensynthesemethoden
Verschillende methoden maken de synthese van koolstofdichloride mogelijk.
Een gebruikelijke aanpak is het “Deacon-proces”, waarbij chloorgas bij verhoogde temperaturen reageert met koolmonoxide in aanwezigheid van een geschikte katalysator zoals koper(II)chloride . Een andere methode omvat de “directe chlorering” van koolmonoxide met chloorgas, mogelijk gemaakt door ijzer of andere metaalchloriden als katalysatoren.
De productie van koolzuurdichloride omvat de “oxidatieve carbonylering” van methyleenchloride of methylchloride, waarbij gebruik wordt gemaakt van zuurstof en een metaalkatalysator zoals cuprochloride. Een andere methode om koolzuurdichloride te synthetiseren is de “ureumroute”, waarbij koolzuurdichloride als bijproduct ontstaat tijdens de productie van ureum.
Het is echter essentieel op te merken dat koolstofdichloride een zeer gevaarlijke stof is en dat de synthese ervan de grootst mogelijke zorg en expertise vereist. Werknemers moeten deze processen uitvoeren in goed gecontroleerde industriële omgevingen met strikte veiligheidsmaatregelen en beschermende uitrusting om blootstelling aan giftige gassen te voorkomen en hun veiligheid en die van het milieu te garanderen.
Gebruik van fosgeen
Koolzuurdichloride heeft verschillende industriële toepassingen vanwege zijn unieke eigenschappen, maar het is belangrijk op te merken dat het gebruik ervan met uiterste voorzichtigheid moet worden behandeld vanwege de giftige aard ervan. Hier zijn enkele toepassingen:
- Chemische tussenproducten: Koolzuurdichloride helpt bij de productie van verschillende essentiële chemicaliën, waaronder isocyanaten, die een essentiële rol spelen bij de productie van polyurethaanschuim, coatings en lijmen.
- Productie van pesticiden: Koolzuurdichloride vergemakkelijkt de synthese van bepaalde pesticiden en herbiciden en draagt zo bij aan gewasbescherming en ongediertebestrijding.
- Productie van polycarbonaat: Koolstofdioxide is een cruciaal onderdeel bij de productie van polycarbonaatkunststoffen en wordt gebruikt in een breed scala aan producten, van brillen tot waterflessen.
- Textielindustrie: Koolzuurdichloride is betrokken bij de productie van specifieke kleurstoffen en andere chemicaliën die in de textielindustrie worden gebruikt.
- Schuimproductie: Kooldioxide speelt een sleutelrol bij de productie van schuimmaterialen, waaronder sommige soorten schuim die bij isolatie worden gebruikt.
- Farmaceutische producten: Koolzuurdichloride fungeert als een chemisch tussenproduct bij de productie van bepaalde farmaceutische producten.
- Laboratoriumonderzoek: Onderzoekers gebruiken soms koolstofdichloride in laboratoriumexperimenten.
- Productie van synthetisch rubber: Kooldioxide is een integraal onderdeel van de productie van sommige synthetische rubbers.
- Waterzuivering: Koolzuurdichloride werd voorheen in kleine hoeveelheden gebruikt voor waterzuivering, maar tegenwoordig worden voor dit doel vaker veiliger alternatieven gebruikt.
Hoewel koolstofdichloride belangrijke industriële toepassingen heeft, vereisen de hoge toxiciteit en gevaarlijke eigenschappen strikte veiligheidsmaatregelen tijdens het hanteren, opslaan en transporteren om ongelukken te voorkomen en het welzijn van werknemers en mensen te garanderen. de omgeving.
Vragen:
Vraag: Wat doet fosgeengas met een mens?
A: Koolstofdichloridegas kan ademhalingsletsel veroorzaken, wat kan leiden tot ademhalingsmoeilijkheden en mogelijk fataal longoedeem.
Vraag: Wat is fosgeen?
A: Kooldioxide is een zeer giftige chemische verbinding die in verschillende industriële processen wordt gebruikt.
Vraag: Wat is fosgeengas?
A: Koolstofdichloridegas is de gasvormige vorm van de chemische verbinding, bekend om zijn verstikkende en giftige effecten op de luchtwegen.
Vraag: Wat doet fosgeen met het lichaam?
A: Kooldioxide kan de longen beschadigen, waardoor vochtophoping en ernstige ademhalingsproblemen ontstaan.
Vraag: Hoe vaak zal Grignard reageren met fosgeen?
A: Het Grignard-reagens reageert slechts één keer met koolstofdichloride en vormt een keton.
Vraag: Welk menselijk orgaan wordt door chloorgas en fosgeen aangevallen?
A: Chloor- en koolstofdichloridegassen tasten voornamelijk de longen aan.
Vraag: Hoe doodt fosgeengas je?
A: Koolstofdichloridegas veroorzaakt ernstige longirritatie, wat leidt tot vochtophoping en verstikking.
Vraag: Wie heeft fosgeengas uitgevonden?
A: Kooldioxidegas werd in 1812 ontdekt door de Britse chemicus John Davy.
Vraag: Effecten van koolstofdichloridegas?
A: Koolstofdichloridegas kan ademhalingsschade, longoedeem en in ernstige gevallen de dood veroorzaken.
Vraag: Lewis-structuur van koolstofdioxide?
A: De Lewis-structuur van koolzuurdichloride bestaat uit een koolstof die dubbel gebonden is aan zuurstof en een enkele binding aan twee chlooratomen.
Vraag: Koolstofdichloridegas Eerste Wereldoorlog?
A: Koolstofdichloride werd tijdens de Eerste Wereldoorlog als chemisch wapen gebruikt en had verwoestende gevolgen voor soldaten.
Vraag: Wanneer werd fosgeengas voor het eerst gebruikt?
A: Koolstofdichloridegas werd voor het eerst gebruikt als chemisch wapen tijdens de Eerste Wereldoorlog in 1915.
Vraag: Waar komt fosgeen vandaan?
A: Koolstofdioxide wordt gewoonlijk geproduceerd door chloor te laten reageren met koolmonoxide of andere koolstofhoudende verbindingen.
