Fosforzuur (H3PO4) is een kleur- en geurloos mineraalzuur. Het wordt veel gebruikt in de voedingsmiddelen- en drankenindustrie als smaakstof en als roestremmer in de auto-industrie.
| IUPAC-naam | Fosforzuur |
| Moleculaire formule | H3PO4 |
| CAS-nummer | 7664-38-2 |
| Synoniemen | Orthofosforzuur, trihydroxydooxydofosfor, fosforzuur (V), orthofosforzuur, heldere fosforzuurtechnologie, fosforaeur |
| InChi | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Eigenschappen van fosforzuur
Molaire massa fosforzuur
De molaire massa van fosforzuur is 98,00 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk van de samenstellende atomen van het molecuul op te tellen, namelijk één fosforatoom en drie zuurstofatomen. Molaire massa is een belangrijke eigenschap van een verbinding, omdat deze wordt gebruikt om de hoeveelheid stof in een bepaald monster te berekenen met behulp van het getal van Avogadro. Bovendien wordt de molaire massa van fosforzuur gebruikt om de concentratie van een oplossing door titratie te bepalen.
Fosforzuurformule
De chemische formule voor fosforzuur is H3PO4, wat aangeeft dat het één fosforatoom, drie waterstofatomen en vier zuurstofatomen bevat. Het is een zwak zuur dat maximaal drie waterstofionen aan een base kan doneren. De formule is belangrijk omdat we hiermee chemische vergelijkingen kunnen schrijven en de stoichiometrie kunnen berekenen van chemische reacties waarbij fosforzuur betrokken is. Bovendien wordt de formule gebruikt om de concentratie van een fosforzuuroplossing door titratie te berekenen.
Kookpunt van fosforzuur
Het kookpunt van fosforzuur is 158°C (316°F) bij een druk van 1 atmosfeer. Dit betekent dat bij deze temperatuur en druk de vloeibare fase van fosforzuur zal transformeren in een gasfase. Het kookpunt hangt af van de intermoleculaire krachten die in de verbinding aanwezig zijn en, in het geval van fosforzuur, van de aanwezigheid van waterstofbruggen tussen de moleculen. Kookpunt is een belangrijke fysische eigenschap van een verbinding, omdat het wordt gebruikt om de vluchtigheid ervan te bepalen, wat nuttig is in veel industriële processen.
Smeltpunt van fosforzuur
Het smeltpunt van fosforzuur is 42,35°C (108,23°F). Dit is de temperatuur waarbij de vaste fase van fosforzuur zal transformeren in de vloeibare fase. Het smeltpunt hangt af van de sterkte van de intermoleculaire krachten die in de verbinding aanwezig zijn en, in het geval van fosforzuur, van de aanwezigheid van waterstofbruggen tussen de moleculen. Het smeltpunt is een belangrijke fysische eigenschap van een verbinding, omdat het wordt gebruikt om de zuiverheid ervan te bepalen en de identiteit vast te stellen.
Dichtheid van fosforzuur g/ml
De dichtheid van fosforzuur is 1,685 g/ml bij kamertemperatuur (25°C of 77°F). Dit is de massa van de stof per volume-eenheid. Dichtheid is een fysieke eigenschap van een stof en wordt gebruikt om het volume van een bepaalde massa van de stof of de massa van een bepaald volume van de stof te berekenen. De dichtheid van fosforzuur is belangrijk bij veel industriële processen, waaronder de productie van meststoffen, wasmiddelen en voedseladditieven.
Molecuulgewicht van fosforzuur
Het molecuulgewicht van fosforzuur is 98,00 g/mol. Het is de som van de atoomgewichten van alle atomen in het molecuul. Het molecuulgewicht is een belangrijke eigenschap van een verbinding, omdat het wordt gebruikt om de hoeveelheid stof in een bepaald monster te berekenen. Bovendien wordt het molecuulgewicht van fosforzuur gebruikt om de concentratie van een oplossing door titratie te bepalen.
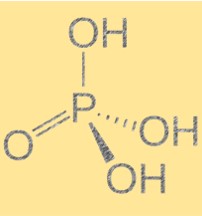
Structuur van fosforzuur (H3PO4)
Fosforzuur heeft een molecuulformule van H3PO4 en een tetraëdrische moleculaire geometrie. Het is een triprotisch zuur, wat betekent dat het drie waterstofionen aan één base kan doneren. Het molecuul bevat een fosforatoom gebonden aan vier zuurstofatomen, waarvan er drie gebonden zijn aan waterstofatomen. De structuur van fosforzuur is belangrijk omdat deze de chemische en fysische eigenschappen ervan bepaalt. De aanwezigheid van waterstofbruggen tussen moleculen leidt tot hoge kook- en smeltpunten.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,685 bij 25°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 98,00 g/mol |
| Dikte | 1,685 g/ml bij 25°C |
| Fusie punt | 42,35°C (108,23°F) |
| Kookpunt | 158°C (316°F) bij een druk van 1 atm |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol, diethylether en aceton |
| Dampdruk | 0,0002 mmHg bij 20°C |
| Dampdichtheid | 3,5 (lucht = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH | 1,0 – 2,5 (geconcentreerde oplossing), 2,8 – 3,2 (verdunde oplossing) |
H3PO4 Veiligheid en gevaren
Fosforzuur brengt verschillende veiligheidsrisico’s met zich mee en moet met zorg worden behandeld. Het kan ernstige huid- en oogirritatie veroorzaken en is zeer bijtend voor metalen. Direct contact met huid, ogen of slijmvliezen kan ernstige brandwonden of zelfs blijvende schade veroorzaken. Het inademen van dampen kan irritatie van de luchtwegen en brandwonden veroorzaken. Het mag niet worden ingenomen, omdat het ernstige inwendige brandwonden en maag-darmklachten kan veroorzaken. Bij het hanteren van fosforzuur moeten geschikte persoonlijke beschermingsmiddelen zoals handschoenen, een veiligheidsbril en een gasmasker worden gedragen. Het moet ook worden bewaard op een koele, droge plaats, uit de buurt van onverenigbare materialen zoals oxidatiemiddelen en alkaliën.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Houd de container goed gesloten. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. |
| VN-identificatienummers | VN1805 |
| HS-code | 280920 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (gemiddeld gevaar) |
| Toxiciteit | Orale LD50 (rat) – 1533 mg/kg |
H3PO4-synthesemethoden
Er bestaan verschillende methoden voor het synthetiseren van fosforzuur (H3PO4).
De meest gebruikelijke methode is het natte proces, waarbij natuurfosfaat met zwavelzuur reageert. Om calciumsulfaat (gips) en H3PO4 te produceren, wordt fosfaatgesteente eerst vermalen en vervolgens gemengd met geconcentreerd zwavelzuur. Na het filteren van de resulterende suspensie zuivert de reeks oplosmiddelextractie- en precipitatiestappen het H3PO4.
Een andere methode om H3PO4 te synthetiseren is het thermische proces waarbij fosfaaterts tot een hoge temperatuur wordt verwarmd om H3PO4 en andere bijproducten zoals elementair fosfor en calciumoxide te produceren. Deze methode is minder gebruikelijk dan het natte proces vanwege de hoge energiebehoefte.
De reactie van fosforpentoxide met water synthetiseert H3PO4. De elektronica- en halfgeleiderindustrie gebruikt deze methode vaak om H3PO4 met hoge zuiverheid te produceren.
Andere methoden voor het synthetiseren van H3PO4 omvatten elektrochemische oxidatie van fosfor, hydrolyse van fosfortrichloride en reactie van fosfor met salpeterzuur . Deze methoden zijn minder gebruikelijk dan natte en thermische processen vanwege hun hoge kosten en complexiteit.
Gebruik van H3PO4
Fosforzuur is een veelzijdige verbinding met een breed scala aan toepassingen in verschillende industrieën. Enkele van de belangrijkste toepassingen zijn:
- Kunstmestproductie: hoofdbestanddeel van de kunstmestproductie, zoals diammoniumfosfaat en drievoudig superfosfaat.
- Voedings- en drankenindustrie: gebruikt als voedingsadditief en smaakstof in verschillende voedingsmiddelen en dranken, zoals coladranken, jam en smeltkaas.
- Industriële reiniging: Wordt gebruikt als reiniger en roestverwijderaar in de industriële sector vanwege het vermogen om roest en andere minerale afzettingen op te lossen.
- Waterbehandeling: Gebruikt om de pH-waarde van water in industriële processen te regelen en ook om zware metalen en andere onzuiverheden te verwijderen.
- Farmaceutische producten: Gebruikt bij de productie van farmaceutische producten en voedingssupplementen vanwege het vermogen om de pH-niveaus te reguleren.
- Tandheelkunde: Gebruikt bij tandheelkundige ingrepen zoals wortelkanaalbehandeling en als onderdeel van tandcement.
- Metaalbehandeling: Wordt gebruikt voor het behandelen en passiveren van metalen zoals roestvrij staal, aluminium en titanium om hun corrosieweerstand te verbeteren.
- Elektronica: Gebruikt in de elektronica-industrie als reinigingsmiddel en als onderdeel bij de productie van halfgeleiders.
Vragen:
Vraag: Wat is de formule voor fosforzuur?
A: De formule voor fosforzuur is H3PO4.
Vraag: Is H3PO4 een sterk zuur?
A: Nee, H3PO4 wordt niet als een sterk zuur beschouwd. Het is een zwak zuur met een pKa-waarde van 2,15.
Vraag: Is H3PO4 een zuur of een base?
A: H3PO4 is een zuur omdat het een proton (H+) afstaat wanneer het in water wordt opgelost.
Vraag: Wat is de Lewis-structuur voor H3PO4?
A: De Lewis-structuur voor H3PO4 is een tetraëdrische structuur met een centraal fosforatoom omgeven door vier zuurstofatomen. Elk zuurstofatoom vormt een enkele binding met het fosforatoom, en er zijn ook drie paren alleenstaande elektronen op elk zuurstofatoom.
Vraag: Is fosforzuur een sterk zuur? A: Nee, fosforzuur wordt niet als een sterk zuur beschouwd. Het is een zwak zuur met een pKa-waarde van 2,15 voor de eerste protonendonatie en 7,20 voor de tweede protonendonatie.
