Fosfortribromide (PBr3) is een verbinding bestaande uit één fosforatoom en drie broomatomen. Het wordt gebruikt als reagens bij verschillende chemische reacties, vooral bij de synthese van organische verbindingen.
| IUPAC-naam | Fosfortribromide |
| Moleculaire formule | PBr3 |
| CAS-nummer | 7789-60-8 |
| Synoniemen | Fosfor(III)bromide, broomfosforbromide, tribroomfosfine |
| InChi | InChI=1S/Br3P/c1-4(2)3 |
Eigenschappen van fosfortribromide
Fosfortribromide-formule
De formule voor fosfor(III)bromide is PBr3. Het bestaat uit één fosforatoom en drie broomatomen. Deze verbinding wordt gevormd wanneer fosfor reageert met broom. De formule geeft nauwkeurig de samenstelling van de verbinding weer.
Fosfortribromide Molaire massa
De molaire massa van fosfor(III)bromide kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Fosfor heeft een atoommassa van ongeveer 31,0 gram per mol, terwijl broom een atoommassa heeft van ongeveer 79,9 gram per mol. Door driemaal de atoommassa van broom aan de atoommassa van fosfor toe te voegen, krijgen we de molaire massa van fosfor(III)bromide, die ongeveer 270,7 gram per mol bedraagt.
Kookpunt van fosfortribromide
Fosfor(III)bromide heeft een kookpunt van ongeveer 173 graden Celsius. Dit betekent dat bij temperaturen boven dit punt de verbinding een faseverandering zal ondergaan van een vloeistof naar een gas. Het kookpunt is een belangrijk kenmerk dat helpt bij het bepalen van de omstandigheden waaronder de verbinding kan worden gebruikt of gezuiverd.
Fosfortribromide smeltpunt
Het smeltpunt van fosfor(III)bromide is ongeveer -41 graden Celsius. Deze temperatuur geeft het punt aan waarop de verbinding verandert van een vaste naar een vloeibare toestand. Het kennen van het smeltpunt is cruciaal voor het hanteren en manipuleren van de verbinding in verschillende chemische processen.
Dichtheid van fosfortribromide g/ml
De dichtheid van fosfor(III)bromide bedraagt ongeveer 2,85 gram per milliliter (g/ml). Dichtheid meet de massa van een stof per volume-eenheid. Dankzij zijn relatief hoge dichtheid heeft fosfor(III)bromide een hogere dichtheid dan veel andere veel voorkomende vloeistoffen, wat aangeeft dat het relatief zwaar is vanwege zijn volume.
Fosfortribromide Molecuulgewicht
Het molecuulgewicht van fosfor(III)bromide bedraagt ongeveer 270,7 gram per mol. Deze waarde wordt berekend door de atoommassa’s van alle atomen in de verbinding op te tellen, gebaseerd op de molecuulformule PBr3. Het molecuulgewicht is nuttig bij verschillende berekeningen, waaronder het bepalen van de hoeveelheid stof die in een bepaalde massa aanwezig is.
Structuur van fosfortribromide
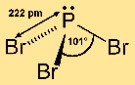
Fosfor(III)bromide heeft een piramidale moleculaire structuur. Het bestaat uit een centraal fosforatoom gebonden aan drie broomatomen. Deze opstelling geeft het molecuul een trigonale piramidevorm, met het fosforatoom bovenaan en de broomatomen aan de basis. Deze structuur is belangrijk voor het begrijpen van de reactiviteit en het gedrag van de verbinding bij chemische reacties.
Oplosbaarheid van fosfortribromide
Fosfor(III)bromide is slecht oplosbaar in water. Het reageert met water en produceert broomwaterstofzuur en fosforzuur. Het is echter oplosbaar in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof. Oplosbaarheid bepaalt de mate waarin een verbinding kan oplossen in een bepaald oplosmiddel, wat gevolgen heeft voor de toepassingen en hantering ervan in verschillende processen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 2,85 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 270,7 g/mol |
| Dikte | 2,85 g/ml |
| Fusie punt | -41°C |
| Kookpunt | 173°C |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van fosfortribromide
Fosfor(III)bromide brengt enkele veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het is bijtend en kan ernstige brandwonden veroorzaken bij contact met de huid, ogen of luchtwegen. Inademing of directe inname van deze verbinding kan irritatie van de luchtwegen en het maagdarmkanaal veroorzaken. Het reageert heftig met water, waarbij giftige dampen vrijkomen en hitte ontstaat. Bij het werken met fosfor(III)bromide moeten adequate ventilatie en persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gebruikt. Bovendien moet het uit de buurt van onverenigbare stoffen worden bewaard om mogelijke reacties te voorkomen. Over het algemeen zijn strikte naleving van veiligheidsprotocollen en kennis van de gevaren die aan deze stof zijn verbonden essentieel voor een veilige omgang.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Afhandelen met borg. Vermijd contact met de huid, ogen en luchtwegen. Gebruik voldoende ventilatie en persoonlijke beschermingsmiddelen. Uit de buurt van onverenigbare stoffen bewaren. |
| VN-identificatienummers | VN1805 |
| HS-code | 2812.90.90 |
| Gevarenklasse | 8 (corrosief) |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inademing en inslikken. Kan ernstige brandwonden en irritatie veroorzaken. |
Methoden voor de synthese van fosfortribromide
Bij een gebruikelijke methode voor het synthetiseren van fosfor(III)bromide combineert het reactievat direct elementair fosfor en broom, gewoonlijk onder gecontroleerde omstandigheden. De reactie verloopt met de overdracht van broomatomen naar fosforatomen, resulterend in de vorming van fosfor (III) bromide.
Een andere methode omvat de reactie tussen fosfortrichloride (PC13) en waterstofbromide (HBr) . Bij deze benadering reageert fosfortrichloride eerst met waterstofbromidegas, waarbij fosfor (III) bromide en waterstofchloridegas als bijproducten worden geproduceerd. Deze methode biedt een alternatieve route voor het verkrijgen van fosfor(III)bromide.
Bij de “rode fosformethode” wordt rode fosfor gecombineerd met broom of broomwaterstofzuur en wordt de reactie onder gecontroleerde omstandigheden uitgevoerd. Rode fosfor dient als een bron van fosfor en reageert met broom of broomwaterstofzuur om fosfor (III) bromide te produceren.
Deze synthetische methoden openen mogelijkheden voor de productie van fosfor(III)bromide, elk met hun eigen voordelen en overwegingen. De keuze van de methode hangt af van factoren zoals de beschikbaarheid van reagentia, de gewenste opbrengst en specifieke reactieomstandigheden. Het is belangrijk om deze syntheses uit te voeren in een goed uitgerust laboratorium, waarbij de veiligheidsprotocollen en procedures voor de omgang met de betrokken chemicaliën worden gerespecteerd.
Gebruik van fosfortribromide
Fosfor(III)bromide vindt verschillende toepassingen vanwege zijn reactiviteit en unieke eigenschappen. Hier zijn enkele toepassingen:
- Organische synthese: Chemici gebruiken fosfor(III)bromide op grote schaal als reagens bij de organische synthese om alcoholen om te zetten in alkylbromiden, een belangrijke stap in de synthese van veel organische verbindingen.
- Farmaceutische industrie: De productie van farmaceutische producten is sterk afhankelijk van fosfor(III)bromide voor de synthese van verschillende tussenproducten voor geneesmiddelen en actieve farmaceutische ingrediënten (API).
- Vlamvertragers: Fabrikanten gebruiken fosfor(III)bromide bij de productie van vlamvertragers, waardoor de brandwerende eigenschappen van bepaalde polymeren voor gebruik in industrieën zoals elektronica en textiel worden verbeterd.
- Chemische productie: Fosfor(III)bromide dient als een waardevol tussenproduct bij de productie van andere chemicaliën, waaronder fosforverbindingen zoals fosforzuurderivaten, fosfonaten en fosfaten.
- Herbiciden en pesticiden: Bij de synthese van specifieke actieve ingrediënten die worden gebruikt in herbiciden en pesticiden wordt gebruik gemaakt van fosfor(III)bromide om onkruid, plagen en ziekten in de landbouw effectief te bestrijden.
- Laboratoriumonderzoek: In het laboratorium gebruiken onderzoekers fosfor (III) bromide gewoonlijk als reagens in verschillende experimenten en reacties, vooral die waarbij bromering en manipulatie van organische verbindingen betrokken zijn.
- Chemische analyse: Fosfor(III)bromide vindt toepassing in chemische analysetechnieken, waardoor de aanwezigheid van specifieke functionele groepen in organische verbindingen kan worden bepaald door middel van broomsubstitutiereacties.
Deze uiteenlopende toepassingen benadrukken het belang van fosfor(III)bromide in organische synthese, farmaceutische producten, vlamvertragers, chemische productie, landbouw, laboratoriumonderzoek en chemische analyse. Zijn reactiviteit en veelzijdigheid maken het een waardevolle verbinding in verschillende industrieën en wetenschappelijke disciplines.
Vragen:
Vraag: Waarom wordt AlBr3 aluminiumbromide genoemd, terwijl PBr3 fosfortribromide is?
A: De naamgevingsconventie voor verbindingen waarbij metalen betrokken zijn, gebruikt over het algemeen de elementaire naam van het metaal gevolgd door de naam van het niet-metaal, terwijl in het geval van PBr3 fosfor wordt gespecificeerd om de aanwezigheid van een centraal fosforatoom aan te duiden.
Vraag: Welk woord of zinsnede van twee woorden beschrijft het beste de vorm van fosfortribromide?
A: De vorm van fosfor(III)bromide kan het beste worden omschreven als trigonaal piramidaal.
Vraag: Hoeveel valentie-elektronen zijn er in het molecuul fosfortribromide, PBr3?
A: Fosfor(III)bromide (PBr3) heeft 26 valentie-elektronen.
Vraag: Is fosfortribromide ionisch of covalent?
A: Fosfor(III)bromide (PBr3) is een covalente verbinding.
Vraag: Wat is de chemische formule van fosfortribromide?
A: De chemische formule voor fosfor(III)bromide is PBr3.
Vraag: Lewis-structuur voor fosfortribromide, PBr3?
A: De Lewis-structuur van PBr3 toont fosfor als het centrale atoom omgeven door drie gebonden broomatomen, elk verbonden door een enkele binding.
Vraag: Is PBr3 een inversie?
A: Nee, fosfor(III)bromide (PBr3) vertoont geen inversie.
Vraag: Is PBr3 een elektrofiel?
A: Ja, PBr3 kan bij bepaalde reacties als elektrofiel werken, waarbij het elektronen accepteert.
Vraag: Wat is de moleculaire geometrie van PBr3?
A: De moleculaire geometrie van PBr3 is trigonaal piramidaal.
Vraag: Is PBr3 polair of niet-polair?
A: PBr3 is een polair molecuul vanwege de ongelijkmatige verdeling van de elektronendichtheid veroorzaakt door de aanwezigheid van polaire P-Br-bindingen.
Vraag: Hoeveel mol PBr3 bevat 3,68 × 10^25 broomatomen?
A: Om het aantal mol te bepalen, hebben we de molaire massa van PBr3 nodig, en vervolgens delen we het gegeven aantal broomatomen door het getal van Avogadro.
Vraag: Wat is de juiste naam voor PBr3?
A: De juiste naam voor PBr3 is fosfor(III)bromide.
Vraag: Is PBr3 polair?
A: Ja, PBr3 is een polair molecuul vanwege de aanwezigheid van polaire bindingen en een ongelijkmatige verdeling van de elektronendichtheid.
