Fosforpentachloride is een chemische verbinding met de formule PCl5. Het wordt gebruikt als reagens bij verschillende chemische reacties. Het reageert krachtig met water, waarbij waterstofchloridegas vrijkomt.
| IUPAC-naam | Fosforpentachloride |
| Moleculaire formule | PCl5 |
| CAS-nummer | 10026-13-8 |
| Synoniemen | Pentachloorfosforaan, fosfor (V) chloride, fosforchloride, fosfor (V) chloride |
| InChi | InChI=1S/Cl5P/c1-6(2,3,4)5 |
Eigenschappen van fosforpentachloride
Fosforpentachloride-formule
De formule voor fosforpentachloride is PCl5. Het bestaat uit één fosforatoom gebonden aan vijf chlooratomen. De formule vertegenwoordigt de verhouding van atomen in de verbinding.
Fosforpentachloride Molaire massa
De molaire massa van fosfor(V)chloride wordt berekend door de atoommassa’s van alle samenstellende elementen bij elkaar op te tellen. Fosfor heeft een molaire massa van ongeveer 30,97 gram per mol en elk chlooratoom heeft een molaire massa van ongeveer 35,45 gram per mol. Hun toevoeging levert een molaire massa op van ongeveer 208,24 gram per mol voor fosfor (V) chloride.
Kookpunt van fosforpentachloride
Fosfor(V)chloride heeft een kookpunt van ongeveer 167,8 graden Celsius. Bij deze temperatuur ondergaat de verbinding een faseverandering van een vloeistof naar een gas. Het kookpunt wordt beïnvloed door de intermoleculaire krachten die in de verbinding aanwezig zijn.
Fosforpentachloride Smeltpunt
Het smeltpunt van fosfor(V)chloride is ongeveer -93,6 graden Celsius. Dit is de temperatuur waarbij de verbinding verandert van vaste naar vloeibare toestand. Het smeltpunt is een belangrijke eigenschap bij het bepalen van het fysische gedrag van de verbinding.
Dichtheid van fosforpentachloride g/ml
De dichtheid van fosfor(V)chloride bedraagt ongeveer 2,1 gram per milliliter. Dichtheid vertegenwoordigt de massa van een stof per volume-eenheid. De dichtheid van fosfor (V) chloride helpt de rangschikking en de compactheid van de deeltjes te begrijpen.
Fosforpentachloride Moleculair gewicht
Het molecuulgewicht van fosfor(V)chloride is ongeveer 208,24 gram per mol. Het is de som van de atoomgewichten van alle atomen die in de verbinding aanwezig zijn. Het molecuulgewicht is nuttig bij verschillende berekeningen, zoals het bepalen van de hoeveelheid stof in een bepaalde massa of volume.
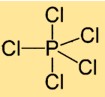
Structuur van fosforpentachloride
Fosfor(V)chloride heeft een moleculaire structuur waarin één fosforatoom omgeven is door vijf chlooratomen. De chlooratomen zijn symmetrisch rond het centrale fosforatoom gerangschikt en vormen een trigonale bipiramidale geometrie.
Oplosbaarheid van fosforpentachloride
Fosfor(V)chloride is slecht oplosbaar in water. Het reageert krachtig met water, waarbij waterstofchloridegas vrijkomt. Het lost echter gemakkelijk op in polaire oplosmiddelen zoals benzeen en tetrachloorkoolstof. De oplosbaarheid van fosfor(V)chloride wordt beïnvloed door de polariteit en chemische eigenschappen van het oplosmiddel.
| Verschijning | Kleurloze kristallen |
| Soortelijk gewicht | 2,1 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 208,24 g/mol |
| Dikte | 2,1 g/ml |
| Fusie punt | -93,6°C |
| Kookpunt | 167,8°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert heftig |
| Oplosbaarheid | Oplosbaar in polaire oplosmiddelen zoals benzeen en tetrachloorkoolstof |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van fosforpentachloride
Fosfor(V)chloride brengt verschillende veiligheidsrisico’s met zich mee. Het is bijtend en kan bij contact ernstige brandwonden aan de huid, ogen en luchtwegen veroorzaken. Inademing van de dampen of het stof kan irritatie en ademhalingsschade veroorzaken. De verbinding reageert heftig met water, waarbij giftig waterstofchloridegas vrijkomt. Het is ook zeer reactief met organische materialen en kan brand of explosies veroorzaken. Bij de omgang met fosfor(V)chloride moeten passende voorzorgsmaatregelen worden genomen, waaronder het gebruik van beschermende uitrusting zoals handschoenen, een veiligheidsbril en een gasmasker. Het moet worden opgeslagen en gehanteerd in een goed geventileerde ruimte, uit de buurt van onverenigbare stoffen, om ongelukken te voorkomen en risico’s te minimaliseren.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Afhandelen met borg. Gebruik geschikte beschermende uitrusting. |
| VN-identificatienummers | VN1806 |
| HS-code | 2812.20.00 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (Gematigd gevaar) |
| Toxiciteit | Giftig bij inslikken of inademen. Kan ernstige irritatie veroorzaken. |
Synthesemethoden voor fosforpentachloride
Verschillende methoden maken de synthese van fosfor (V) chloride mogelijk. Een gebruikelijke methode is de reactie tussen fosfortrichloride (PCl3) en chloorgas (Cl2) . Bij dit proces combineert het reactievat beide verbindingen en initieert warmte of een katalysator zoals ijzer de reactie. Chloorgas werkt als een oxidatiemiddel en zet PCl3 om in PCl5. De reactie verloopt als volgt:
PCl3 + Cl2 → PCl5
Een andere methode om fosfor(V)chloride te synthetiseren omvat de reactie tussen fosfor en chloorgas . Deze methode is directer en omvat de volgende reactie:
P4 + 10Cl2 → 4PCl5
Bij deze reactie reageren fosfor en chloorgas onder geschikte omstandigheden, wat resulteert in de vorming van fosfor(V)chloride.
Het is belangrijk op te merken dat beide synthesemethoden een zorgvuldige omgang en passende veiligheidsmaatregelen vereisen. Bij reacties zijn zeer reactieve en bijtende stoffen betrokken, dus beschermende uitrusting en voldoende ventilatie zijn noodzakelijk. Bovendien is het essentieel om deze reacties in een gecontroleerde omgeving uit te voeren om ongelukken te voorkomen en de veiligheid van het betrokken personeel te garanderen.
Gebruik van fosforpentachloride
Fosfor(V)chloride vindt diverse toepassingen vanwege zijn unieke eigenschappen en reactiviteit. Hier zijn enkele toepassingen:
- Chemische synthese: Bij de organische synthese wordt op grote schaal fosfor (V) chloride gebruikt als reagens om carbonzuren om te zetten in zuurchloriden en alcoholen in alkylchloriden.
- Farmaceutische producten: De synthese van farmaceutische verbindingen, waaronder antibiotica en kleurstoffen, is sterk afhankelijk van fosfor(V)-chloride als belangrijk tussenproduct.
- Katalysator: Fosfor (V) chloride katalyseert verschillende chemische reacties, zoals Friedel-Crafts-acylatie en Beckmann-omlegging.
- Polymeerindustrie: Bij de productie van verschillende polymeren, waaronder polyvinylchloride (PVC) en polycarbonaten, wordt fosfor (V) chloride als chloreringsmiddel gebruikt.
- Laboratoriumtoepassingen: Bij laboratoriumtoepassingen fungeert fosfor(V)chloride als droogmiddel om sporen water uit laboratoriumapparatuur te verwijderen en als chlorerings- en dehydraterend middel bij verschillende reacties.
- Herbiciden en pesticiden: Bij de productie van herbiciden en pesticiden om de groei van onkruid onder controle te houden en ongedierte te elimineren, wordt fosfor (V) chloride gebruikt.
- Middelen voor chemische oorlogvoering: Historisch gezien heeft fosfor(V)chloride actief bijgedragen aan de productie van middelen voor chemische oorlogvoering, maar het gebruik ervan voor dergelijke doeleinden is nu onderworpen aan strikte regelgeving en beperkingen.
- Metaaloppervlaktebehandeling: Metaaloppervlaktebehandelingsprocessen maken gebruik van fosfor (V) chloride om de hechtingseigenschappen te verbeteren en de corrosieweerstand te bevorderen.
- Vlamvertragers: Bij de productie van vlamvertragende additieven voor textiel, kunststoffen en andere materialen wordt fosfor(V)chloride gebruikt.
- Farmaceutische productie: Fosfor(V)chloride vindt toepassingen bij de productie van verschillende farmaceutische producten, waaronder de synthese van vitamines en hormoonderivaten.
Het is belangrijk om voorzichtig om te gaan met fosfor(V)chloride en de juiste veiligheidsprotocollen te volgen vanwege de corrosieve aard ervan en de potentiële gezondheidsrisico’s.
Vragen:
Vraag: Wat is de juiste formule voor fosforpentachloride?
A: De juiste formule voor fosfor(V)chloride is PCl5.
Vraag: Wat is de molecuulformule van fosforpentachloride?
A: De molecuulformule voor fosfor(V)chloride is PCl5.
Vraag: Welke massa fosforpentachloride zou worden geproduceerd door de volledige reactie van 15,2 g P4?
A: De geproduceerde massa fosfor(V)chloride zou ongeveer 208,24 g zijn.
Vraag: Wat is de vorm van fosforpentachloride?
A: De vorm van fosfor (V) chloride is trigonaal bipyramidaal.
Vraag: Wat is de massa van een molecuul fosforpentachloride?
A: De massa van een molecuul fosfor(V)chloride is ongeveer 208,24 gram per mol.
Vraag: Eigenschappen van fosforpentachloride?
A: Fosfor(V)chloride is corrosief, reageert heftig met water en wordt gebruikt als reagens bij de chemische synthese.
Vraag: Bindingshoeken van fosfor (V) chloride?
A: De bindingshoeken in fosforpentachloride zijn ongeveer 120 graden (tussen equatoriale chlooratomen) en 90 graden (tussen axiale chlooratomen).
Vraag: Hoe maak je fosforpentachloride?
A: Fosfor(V)chloride kan worden gemaakt door fosfortrichloride (PCl3) te laten reageren met chloorgas (Cl2) of door directe reactie tussen fosfor en chloorgas.
Vraag: Wat is de elektronische geometrie van fosfor in fosforpentachloride?
A: De elektronische geometrie van fosfor in fosfor (V) chloride is trigonaal bipyramidaal.
