Ethylbenzeen (C8H10) is een organische verbinding met een zoete geur. Het wordt gebruikt als oplosmiddel in verschillende industrieën, waaronder kunststoffen en rubber. Het wordt ook aangetroffen in benzine en wordt gebruikt in de samenstelling van bepaalde huishoudelijke producten.
| IUPAC-naam | Ethylbenzeen |
| Moleculaire formule | C8H10 |
| CAS-nummer | 100-41-4 |
| Synoniemen | Ethylbenzol, EB, fenylethaan, ethylfenyl, 2-fenylethaan, alfa-methyltolueen, 1-fenylethaan, etilbenzeen, styreenverdunner |
| InChi | InChI=1S/C8H10/c1-2-8-6-4-3-5-7-8/h3-7H,2H2,1H3 |
Eigenschappen van ethylbenzeen
Ethylbenzeenformule
De molecuulformule voor ethylbenzeen is C8H10, wat betekent dat het uit acht koolstofatomen en tien waterstofatomen bestaat. De chemische structuur van ethylbenzeen bestaat uit een benzeenring die aan een ethylgroep is bevestigd.
Ethylbenzeen molaire massa
De molaire massa van C8H10 is 106,17 g/mol. Dit wordt berekend door de atoommassa’s van alle atomen in een C8H10-molecuul bij elkaar op te tellen.
Kookpunt van ethylbenzeen
Het kookpunt van C8H10 is 136,2°C (277,2°F). Dit is de temperatuur waarbij de vloeibare vorm van C8H10 overgaat in een gas. C8H10 heeft een relatief laag kookpunt in vergelijking met andere aromatische koolwaterstoffen, waardoor het bruikbaar is als oplosmiddel in verschillende industrieën.
Ethylbenzeen smeltpunt
Het smeltpunt van C8H10 is -95,2°C (-139,4°F). Dit is de temperatuur waarbij de vaste vorm van C8H10 vloeibaar wordt. C8H10 heeft een relatief laag smeltpunt vergeleken met andere aromatische koolwaterstoffen, waardoor het bruikbaar is als grondstof voor de productie van andere chemicaliën.
Ethylbenzeendichtheid g/ml
De dichtheid van C8H10 is 0,867 g/ml bij 20°C (68°F). Dit betekent dat één milliliter C8H10 bij deze temperatuur 0,867 gram weegt. C8H10 heeft een lagere dichtheid dan water, wat betekent dat het op het wateroppervlak zal drijven als de twee vloeistoffen worden gemengd.
Moleculair gewicht van ethylbenzeen
Het molecuulgewicht van C8H10 is 106,17 g/mol. Dit is de massa van een C8H10-molecuul, die kan worden berekend door de atoommassa’s van alle atomen in het molecuul bij elkaar op te tellen.
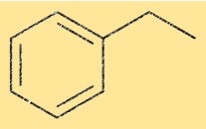
Structuur van ethylbenzeen
De structuur van C8H10 bestaat uit een benzeenring bevestigd aan een ethylgroep. De ethylgroep is gebonden aan een van de koolstofatomen van de benzeenring. Deze structuur wordt ook wel fenylethaan genoemd.
Oplosbaarheid van ethylbenzeen
C8H10 is onoplosbaar in water maar oplosbaar in organische oplosmiddelen zoals alcoholen, ethers en chloroform. Dit betekent dat C8H10 niet in water oplost, maar wel in andere vloeistoffen met vergelijkbare chemische eigenschappen. De oplosbaarheid van C8H10 in verschillende oplosmiddelen hangt af van factoren zoals temperatuur, druk en chemische eigenschappen van het oplosmiddel.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,867 g/ml bij 20°C |
| Kleur | Kleurloos |
| Geur | Zoete geur |
| Molaire massa | 106,17 g/mol |
| Dikte | 0,867 g/ml bij 20°C |
| Fusie punt | -95,2°C (-139,4°F) |
| Kookpunt | 136,2°C (277,2°F) |
| Flitspunt | 11,1°C (52°F) |
| oplosbaarheid in water | 0,30 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals alcoholen, ethers en chloroform |
| Dampdruk | 10,7 mmHg bij 20°C |
| Dampdichtheid | 3.7 |
| pKa | 10.17 |
| pH | Niet toepasbaar |
Veiligheid en gevaren van ethylbenzeen
C8H10 kan gevaarlijk zijn als er niet de juiste voorzorgsmaatregelen worden genomen bij het hanteren en gebruiken ervan. Het is geclassificeerd als een ontvlambare vloeistof en kan ontbranden bij blootstelling aan hitte of vlammen. C8H10 kan ook schadelijk zijn bij inademing of inslikken. Blootstelling aan hoge concentraties C8H10 kan duizeligheid, hoofdpijn en irritatie van de luchtwegen veroorzaken. Langdurige blootstelling aan C8H10 is in verband gebracht met lever- en nierschade. Bij het werken met C8H10 moeten veiligheidsmaatregelen worden genomen, zoals het dragen van beschermende kleding en handschoenen, het werken in goed geventileerde ruimtes en het opslaan ervan op een veilige, koele en droge plaats.
| Gevarensymbolen | Ontvlambaar, schadelijk |
| Beveiligingsbeschrijving | Verwijderd houden van hitte, vonken, open vuur en hete oppervlakken. Gebruik explosieveilige apparatuur. Vermijd inademen van stof/rook/gas/nevel/damp/spuitnevel. Na gebruik goed wassen. |
| VN-identificatienummers | VN 1175 |
| HS-code | 2902.90.20 |
| Gevarenklasse | 3 (Ontvlambare vloeistoffen) |
| Verpakkingsgroep | II (Gemiddeld gevaar) |
| Toxiciteit | Ethylbenzeen wordt beschouwd als een matig giftige stof. Het kan oog- en huidirritatie, ademhalingsproblemen en schade aan het zenuwstelsel veroorzaken bij langdurige blootstelling of bij hoge concentraties. |
Methoden voor de synthese van ethylbenzeen
De meest gebruikte methode om C8H10 te synthetiseren is de katalytische dehydrogenering van ethylcyclohexaan. Bij dit proces wordt een mengsel van ethylcyclohexaan en waterstofgas op hoge temperatuur over een katalysator verwarmd, waardoor de waterstofatomen zich scheiden van de ethylgroep, wat resulteert in de vorming van C8H10.
Een andere methode voor het synthetiseren van C8H10 omvat de alkylering van benzeen met ethyleengas . Deze reactie vereist een katalysator, meestal aluminiumchloride, en resulteert in de vorming van C8H10 en waterstofchloride als bijproduct.
Een alternatieve methode voor het produceren van C8H10 omvat de reactie van benzeen met ethylchloride in aanwezigheid van een Lewis-zuurkatalysator, zoals aluminiumchloride. Dit proces resulteert in de vorming van C8H10 en waterstofchloride als bijproduct.
Naast de genoemde methoden ontwikkelen onderzoekers ook nieuwe methoden voor de synthese van C8H10, zoals het gebruik van ionische vloeistoffen als oplosmiddel voor de ethyleenalkylering van benzeen . Deze methoden hebben het potentieel om voordelen te bieden in termen van efficiëntie en ecologische duurzaamheid. Het industriële gebruik ervan is echter nog niet wijdverspreid.
Gebruik van ethylbenzeen
C8H10 heeft verschillende belangrijke toepassingen in verschillende industrieën. Enkele van de belangrijkste toepassingen zijn:
- Styreenproductie: De productie van styreen, dat wordt gebruikt om een verscheidenheid aan kunststoffen, harsen en synthetisch rubber te maken, gebonden op C8H10 als belangrijk tussenproduct.
- Oplosmiddel: Vaak gebruikt als oplosmiddel voor verschillende toepassingen, waaronder inkten, coatings, lijmen en reinigingsproducten.
- Brandstofadditief: toegevoegd aan benzine om het octaangetal te verbeteren, wat de motorprestaties kan verbeteren.
- Chemisch tussenproduct: gebruikt als grondstof voor de synthese van andere chemicaliën, zoals fenylethanol en diethylbenzeen.
- Polymeerproductie: gebruikt bij de productie van verschillende soorten polymeren, zoals polystyreen en acrylonitril-butadieen-styreen (ABS) harsen.
- Landbouw: Wordt ook gebruikt als pesticide en herbicide.
- Medische toepassingen: Gebruikt als plaatselijk verdovingsmiddel, maar ook als oplosmiddel voor farmaceutische producten.
Vragen:
Vraag: Hoeveel signalen verwacht je te zien in het 1H NMR-spectrum voor ethylbenzeen?
A: Het 1H NMR-spectrum voor C8H10 zou vier signalen hebben: twee voor de protonen op de benzeenring (die als een doublet zouden verschijnen) en twee voor de protonen op de ethylgroep (die als een triplet zouden verschijnen).
Vraag: Welke hoeveelheden benzeen en ethylbenzeen moeten worden gemengd?
A: De te mengen verhoudingen benzeen en C8H10 zijn afhankelijk van de gewenste concentratie C8H10 in het mengsel. De verhouding benzeen/C8H10 kan variëren van 10:1 tot 1:1, afhankelijk van de toepassing.
Vraag: Wat is ethylbenzeennitrering?
A: Nitratie van C8H10 omvat de reactie van C8H10 met een mengsel van salpeterzuur en zwavelzuur, resulterend in de introductie van een of meer nitrogroepen op de benzeenring van C8H10. Deze reactie wordt vaak gebruikt bij de productie van industriële chemicaliën zoals nitrobenzeen en fenylethylamines.
Vraag: Is ethylbenzeen polair?
A: C8H10 is een niet-polaire verbinding vanwege de symmetrische structuur van de benzeenring, die elke polariteit van de ethylgroep teniet doet. Als gevolg hiervan heeft C8H10 een lage oplosbaarheid in water en is het over het algemeen oplosbaar in niet-polaire oplosmiddelen zoals hexaan en tolueen.
Vraag: Hoe kan ik overstappen van ethylbenzeen naar styreen?
A: C8H10 kan worden omgezet in styreen via het dehydrogeneringsproces, waarbij twee waterstofatomen uit de ethylgroep worden verwijderd met behulp van een katalysator zoals ijzeroxide of chroomoxide. Dit proces resulteert in de vorming van styreen en waterstofgas als bijproduct. Het resulterende styreen kan vervolgens worden gezuiverd en gebruikt bij de productie van verschillende industriële materialen zoals kunststoffen, harsen en synthetisch rubber.
