Ethylacetaat is een kleurloze vloeistof met een fruitige geur. Het wordt vaak gebruikt als oplosmiddel in verschillende industrieën, waaronder de farmaceutische, cosmetische en voedingsmiddelenindustrie. Ethylacetaat is licht ontvlambaar en moet met zorg worden gehanteerd.
| IUPAC-naam | Ethylacetaat |
| Moleculaire formule | C4H8O2 |
| CAS-nummer | 141-78-6 |
| Synoniemen | Azijnzuur Ethyl Ester, Ethyl Ethanoaat, Acetoxyethaan, Acetidine, Ethylacetaat, Ethyl Azijnzuur Ester |
| InChi | InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
Eigenschappen van ethylacetaat
Dichtheid van ethylacetaat g/ml
De dichtheid van ethylethanoaat is 0,902 g/ml onder standaard temperatuur- en drukomstandigheden. Deze dichtheid geeft aan dat ethylethanoaat een lagere dichtheid heeft dan water en erop zal drijven. Deze eigenschap maakt het nuttig voor het scheiden van vloeistofmengsels via het vloeistof-vloeistofextractieproces.
Structuur van ethylacetaat
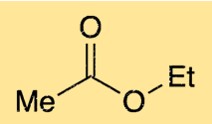
De structuur van ethylethanoaat bestaat uit een keten van vier koolstofatomen met een functionele estergroep. De functionele estergroep bestaat uit een zuurstofatoom gebonden aan een koolstofatoom, dat op zijn beurt gebonden is aan een ander zuurstofatoom. Het zuurstofatoom op de estergroep is ook gebonden aan een van de koolstofatomen in de vierkoolstofketen. Deze structuur geeft ethylethanoaat zijn karakteristieke fruitige geur.
Molaire massa van ethylacetaat
De molaire massa van ethylacetaat is 88,11 g/mol. Het wordt bepaald door de atoomgewichten van alle atomen in een ethylacetaatmolecuul op te tellen. De molecuulformule voor ethylacetaat is C4H8O2, wat aangeeft dat elk molecuul 4 koolstofatomen, 8 waterstofatomen en 2 zuurstofatomen bevat. De molaire massa van ethylacetaat wordt bij veel berekeningen gebruikt, zoals het bepalen van de hoeveelheid stof in een bepaald monster of de massa van een stof in een bepaald volume.
Kookpunt van ethylacetaat
Het kookpunt van ethylethanoaat is 77,1°C (171,8°F) bij standaarddruk. Ethylethanoaat heeft een relatief laag kookpunt, waardoor het in veel industriële toepassingen bruikbaar is als oplosmiddel voor extractie, zuivering en reiniging. Bij verhitting tot het kookpunt verdampt ethylethanoaat en kan door condensatie als zuivere vloeistof worden opgevangen.
Smeltpunt van ethylacetaat
Het smeltpunt van ethylethanoaat is -83,6°C (-118,5°F). Dit lage smeltpunt betekent dat ethylethanoaat gewoonlijk in vloeibare vorm wordt aangetroffen in plaats van vast bij kamertemperatuur. Het kan echter stollen bij extreem lage temperaturen of onder druk. De vaste vorm van ethylethanoaat is gewoonlijk een wit kristallijn poeder.
Molecuulgewicht van ethylacetaat
Het molecuulgewicht van ethylethanoaat is 88,11 g/mol. Deze waarde vertegenwoordigt de massa van één mol ethylethanoaatmoleculen. Het molecuulgewicht wordt bij veel berekeningen gebruikt, zoals het bepalen van de hoeveelheid stof in een bepaald monster of de massa van een stof in een bepaald volume.
Ethylacetaatformule
De chemische formule voor ethylethanoaat is C4H8O2. Deze formule vertegenwoordigt het aantal en het type atomen waaruit een ethylethanoaatmolecuul bestaat. De vier koolstofatomen in de formule zijn gerangschikt in een keten, waarbij elk koolstofatoom gebonden is aan twee andere atomen. Twee van de koolstofatomen zijn ook gebonden aan de zuurstofatomen in de functionele estergroep. De overige twee koolstofatomen zijn elk gebonden aan drie waterstofatomen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,902 g/cm³ |
| Kleur | Kleurloos |
| Geur | Fruitig, zoet |
| Molaire massa | 88,11 g/mol |
| Dikte | 0,902 g/cm³ |
| Fusie punt | -83,6°C |
| Kookpunt | 77,1°C |
| Flitspunt | -4°C |
| oplosbaarheid in water | 80 g/l bij 20°C |
| Oplosbaarheid | Oplosbaar in alcohol, ether, aceton, chloroform |
| Dampdruk | 73,3 mmHg bij 20°C |
| Dampdichtheid | 3.04 |
| pKa | 4,76 |
| pH | Neutrale |
Ethylethanoaat is een kleurloze vloeistof die veel wordt gebruikt in verschillende industriële en laboratoriumtoepassingen. Het brengt echter bepaalde veiligheids- en gezondheidsrisico’s met zich mee waarmee rekening moet worden gehouden om een veilige hantering en gebruik te garanderen. Blootstelling aan ethylethanoaat kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Het kan ook hoofdpijn, duizeligheid en misselijkheid veroorzaken. Ethylethanoaat is ontvlambaar en kan brand of explosies veroorzaken bij blootstelling aan hitte of vlammen. Het is belangrijk om ethylethanoaat op te slaan en te hanteren in een goed geventileerde ruimte, uit de buurt van ontstekingsbronnen. In geval van accidentele blootstelling moet onmiddellijk medische hulp worden ingeroepen om verdere schade te voorkomen. Bij het hanteren van ethylethanoaat moeten de juiste veiligheidsmaatregelen en beschermende uitrusting worden gebruikt om het risico op letsel of schade te minimaliseren.
| Gevarensymbolen | Xi, F |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Verwijderd houden van ontstekingsbronnen. Gebruik in een goed geventileerde ruimte. |
| AN-identificaties | VN1173 |
| HS-code | 2915.31.00 |
| Gevarenklasse | 3 – Ontvlambare vloeistoffen |
| Verpakkingsgroep | GE II |
| Toxiciteit | LD50 (oraal, rat) – 2 g/kg |
Methoden voor de synthese van ethylacetaat
Twee hoofdmethoden, verestering en dehydrogenering, synthetiseren actief ethylethanoaat in de industrie met hoge opbrengsten.
De veresteringsmethode omvat de reactie tussen ethanol en azijnzuur in aanwezigheid van een sterk zure katalysator, zoals zwavelzuur. Door destillatie worden het uit de reactie resulterende ethylethanoaat en water gescheiden, waardoor hoge opbrengsten aan ethylethanoaat worden verkregen, dat gewoonlijk in de industrie wordt gebruikt.
De dehydrogeneringsmethode omvat de reactie van ethanol en azijnzuur over een koper(II)oxide-katalysator bij hoge temperatuur. De katalysator bevordert de dehydrogenering van ethanol om ethyleen te produceren, dat vervolgens reageert met azijnzuur om ethylethanoaat te vormen. Deze methode is minder gebruikelijk dan verestering en vereist in het algemeen hogere temperaturen en langere reactietijden.
Een andere methode voor het synthetiseren van ethylethanoaat omvat het laten reageren van ethanol en azijnzuuranhydride. Deze methode resulteert in de productie van ethylethanoaat en azijnzuur, die door destillatie kunnen worden gescheiden.
Gebruik van ethylacetaat
Ethylethanoaat is een veelzijdige chemische verbinding die veel wordt gebruikt in verschillende industriële en consumententoepassingen. Enkele van de meest voorkomende toepassingen van ethylethanoaat zijn:
- Oplosmiddel: Fabrikanten gebruiken het als krachtig oplosmiddel in verven, coatings en lijmen.
- Smaakstof: gebruikt als smaakstof in de voedingsmiddelen- en drankenindustrie, met name bij de productie van dranken met fruitsmaak.
- Geur: Een veelgebruikt ingrediënt in parfums, colognes en andere producten voor persoonlijke verzorging vanwege de aangename fruitige geur.
- Extractie van etherische oliën: Gebruikt bij de extractie van essentiële oliën uit planten en bloemen.
- Farmaceutische producten: Gebruikt als oplosmiddel bij de productie van farmaceutische producten, vooral bij de productie van antibiotica.
- Reinigingsmiddel: gebruikt om elektronische apparaten, textiel en andere materialen schoon te maken.
- Kunstleer: Fabrikanten van kunstleer verzachten en maken het materiaal soepeler door ethylacetaat als weekmaker te gebruiken.
- Chemisch tussenproduct: Chemische producenten creëren andere chemicaliën, zoals celluloseacetaat, vinylacetaat en ethylacrylaat, waarbij ze ethylethanoaat als chemisch tussenproduct gebruiken.
Vragen:
Vraag: Is ethylacetaat polair of niet-polair?
A: Ethylethanoaat is een polair oplosmiddel vanwege de aanwezigheid van een carbonylgroep (C = O) en een zuurstofatoom in de moleculaire structuur. Het is echter niet zo polair als andere oplosmiddelen zoals water of ethanol.
Vraag: Is ethylacetaat mengbaar met water?
A: Ethylethanoaat is niet mengbaar met water, wat betekent dat het niet goed mengt met water. Dit komt door het verschil in polariteit tussen de twee stoffen, aangezien water een zeer polair oplosmiddel is en ethylethanoaat een minder polair oplosmiddel.
Vraag: Is ethylacetaat oplosbaar in water?
A: Ethylethanoaat is enigszins oplosbaar in water, met een oplosbaarheid van ongeveer 8% bij kamertemperatuur. Deze oplosbaarheid is echter beperkt vanwege het verschil in polariteit tussen de twee stoffen. Ethylethanoaat is beter oplosbaar in niet-polaire oplosmiddelen zoals hexaan of tolueen.
