Ethyleen, ook wel ethyleen genoemd, is een kleurloos, brandbaar gas met een zoete geur. Het is een essentieel onderdeel van de chemische industrie en wordt gebruikt bij de productie van kunststoffen, oplosmiddelen en andere chemicaliën.
| Naam van IUPAC | Etheen |
| Moleculaire formule | C2H4 |
| CAS-nummer | 74-85-1 |
| Synoniemen | Ethyleen, Etheen (ten onrechte), Oleificerend gas, Elayl, 1,2-Diwaterstofethyleen |
| InChi | InChI=1S/C2H4/c1-2/h1-2H2 |
Ethyleen formule
De chemische formule voor etheen is C2H4. Het vertegenwoordigt het aantal en het type atomen dat aanwezig is in een etheenmolecuul. De formule wordt gebruikt bij chemische reacties en berekeningen waarbij ethyleen betrokken is, zoals het bepalen van de stoichiometrie van een reactie of de hoeveelheid ethyleen die nodig is voor een bepaald industrieel proces.
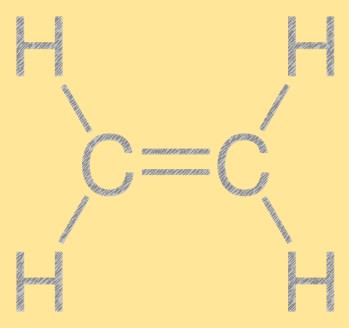
Ethyleen structuur
Ethyleen heeft een eenvoudige lineaire structuur, met twee koolstofatomen verbonden door een dubbele binding en vier waterstofatomen aan elk koolstofatoom. De dubbele koolstof-koolstofbinding is verantwoordelijk voor de reactiviteit van ethyleen, waardoor het een nuttige bouwsteen is in de chemische industrie. Het molecuul heeft een vlakke structuur, waarbij alle atomen in hetzelfde vlak liggen.
Etheen Molaire Massa
De molaire massa van etheen, ook wel ethyleen genoemd, is 28,05 g/mol. Het is een eenvoudig organisch molecuul dat bestaat uit twee koolstofatomen en vier waterstofatomen, weergegeven door de chemische formule C2H4. De molaire massa wordt berekend door de atoommassa’s van de individuele atomen in het molecuul op te tellen.
Molaire massa is een belangrijke parameter bij chemische reacties en berekeningen met ethyleen. Het wordt gebruikt om de hoeveelheid ethyleen te bepalen die nodig is bij een reactie, evenals de hoeveelheid producten die geproduceerd kunnen worden.
Kookpunt van ethyleen
Het kookpunt van etheen is -103,7°C (-154,7°F). Ethyleen is een gas bij kamertemperatuur en druk, en het kookpunt is veel lager dan dat van water, waardoor het gemakkelijker te scheiden is van andere stoffen in industriële processen.
Het kookpunt van etheen hangt af van de druk en zuiverheid van het monster. Bij hogere drukken neemt het kookpunt van etheen toe. Op dezelfde manier kunnen onzuiverheden in het monster ervoor zorgen dat het kookpunt afwijkt van de verwachte waarde.
Smeltpunt van etheen
Het smeltpunt van ethyleen is -169,2°C (-272,6°F). Ethyleen is een niet-polair molecuul met een lineaire vorm, waardoor het een relatief eenvoudig molecuul is vergeleken met veel andere organische verbindingen. Dit komt tot uiting in het lage smeltpunt.
Net als het kookpunt kan het smeltpunt van ethyleen variëren afhankelijk van de zuiverheid van het monster. Onzuiverheden kunnen het smeltpunt verlagen en het moeilijk maken om een zuiver monster voor experimentele doeleinden te verkrijgen.
Ethyleendichtheid g/ml
De dichtheid van ethyleen is 0,958 g/ml onder standaard temperatuur- en drukomstandigheden (STP), gedefinieerd als 0°C (32°F) en 1 atm druk. Ethyleen heeft een lagere dichtheid dan lucht, wat betekent dat het kan opstijgen en zich in de atmosfeer kan verspreiden.
Dichtheid is een belangrijke fysische eigenschap van ethyleen, omdat deze in industriële processen wordt gebruikt om de hoeveelheid ethyleen te bepalen die nodig is voor een bepaald ruimtevolume. Het wordt ook gebruikt om de massa ethyleen in een monster te berekenen.
Molecuulgewicht van ethyleen
Het molecuulgewicht van ethyleen is 28,05 g/mol. Het is de som van de atoomgewichten van de atomen waaruit het molecuul bestaat. Het molecuulgewicht is een belangrijke parameter bij veel chemische berekeningen, vooral bij het bepalen van de stoichiometrie van een reactie en de hoeveelheid reactanten en producten die nodig zijn of worden geproduceerd.
| Verschijning | Kleurloos gas |
| Specifieke dichtheid | 0,968 g/ml bij 20°C (68°F) |
| Kleur | Kleurloos |
| Geur | Zoet, kruidig |
| Molaire massa | 28,05 g/mol |
| Dikte | 0,958 g/ml bij 0°C en 1 atm |
| Fusie punt | -169,2°C (-272,6°F) |
| Kookpunt | -103,7°C (-154,7°F) bij een druk van 1 atm |
| Flitspunt | -136°C (-213°F) |
| oplosbaarheid in water | 3,5 g/l bij 25°C (77°F) |
| Oplosbaarheid | Onoplosbaar in water, oplosbaar in organische oplosmiddelen |
| Dampdruk | 114,6 kPa bij 20°C (68°F) |
| Dampdichtheid | 0,97 (lucht = 1) |
| pKa | 44 |
| pH | Niet van toepassing, aangezien ethyleen geen waterige oplossing is |
Ethyleenveiligheid en gevaren
Ethyleen is een licht ontvlambaar gas dat met lucht explosieve mengsels kan vormen. Het kan spontaan ontbranden in de lucht als de concentratie hoog genoeg is. Ethyleen is ook een verstikkend middel en kan zuurstof in besloten ruimtes verdringen, wat een schokkend gevaar met zich meebrengt.
Contact met vloeibaar ethyleen of blootstelling aan hoge concentraties gas kan bevriezing of brandwonden veroorzaken. Ethyleen is niet giftig, maar de verbrandingsproducten ervan, waaronder koolmonoxide en kooldioxide, kunnen gevaarlijk zijn voor de menselijke gezondheid.
Het hanteren van ethyleen vereist passende veiligheidsmaatregelen, waaronder adequate ventilatie, persoonlijke beschermingsmiddelen en brandveiligheidsmaatregelen. Ethyleen moet worden opgeslagen en getransporteerd in goed geventileerde ruimtes, uit de buurt van ontstekingsbronnen.
| Gevarensymbolen | Ontvlambaar gas (GHS02), eenvoudig verstikkend (GHS09) |
| Beveiligingsbeschrijving | Verwijderd houden van ontstekingsbronnen – Niet roken. Gebruik uitsluitend vonkvrij gereedschap. Adem geen gas in. Alleen buitenshuis of in een goed geventileerde ruimte gebruiken. Draag beschermende handschoenen/beschermende kleding/oogbescherming/gelaatsbescherming. |
| VN-identificatienummers | VN 1962 (gecomprimeerd gas) |
| HS-code | 2901.21.00 |
| Gevarenklasse | 2.1 (ontvlambaar gas) |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Niet giftig |
Methoden voor ethyleensynthese
Er kunnen verschillende methoden worden gebruikt om ethyleen te synthetiseren, waaronder thermisch kraken van koolwaterstoffen en dehydratatie van alcoholen.
Bij thermisch kraken omvat het proces het verwarmen van koolwaterstoffen zoals methaan, propaan en nafta op hoge temperaturen (500 tot 900 ° C) in aanwezigheid van een katalysator om moleculen met lange ketens af te breken tot kleinere moleculen, waardoor ethyleen wordt geproduceerd. producten.
Een andere gebruikelijke methode is dehydratatie van alcohol, waarbij een katalysator zoals aluminiumoxide of silica bij hoge temperaturen (250-350°C) wordt gebruikt om ethanol of andere alcoholen te dehydrateren en ethyleen en water te vormen.
Stoomkraken is een ander proces dat wordt gebruikt om ethyleen te produceren, waarbij stoom bij hoge temperaturen (700-900°C) aan koolwaterstoffen wordt toegevoegd om een mengsel van ethyleen en andere producten te genereren.
Bij de thermische afbraak van organische materialen zoals hout, papier en kunststoffen kan ook ethyleen ontstaan.
Andere methoden voor het synthetiseren van ethyleen omvatten de oxidatieve dehydrogenering van ethaan en het proces van het omzetten van methanol in olefinen.
Gebruik van ethyleen
Ethyleen is een belangrijke industriële chemische stof met een breed scala aan toepassingen.
- Ethyleen speelt een cruciale rol bij de productie van polyethyleen, een van de meest gebruikte kunststoffen ter wereld. Mensen gebruiken polyethyleen in verschillende toepassingen zoals verpakkingen, buizen en bouwmaterialen.
- Fabrikanten gebruiken ethyleen als een belangrijk ingrediënt bij de productie van andere polymeren, zoals polyvinylchloride (PVC). PVC is nuttig in bouwmaterialen, medische apparaten en elektrische kabels.
- Ethyleen is ook cruciaal bij de productie van ethyleenoxide, een essentiële grondstof bij de productie van wasmiddelen, oplosmiddelen en kunststoffen.
- Fabrikanten gebruiken ethyleen om ethyleenglycol te produceren, een koelvloeistof en antivriesmiddel voor motoren. Het is ook een grondstof bij de vervaardiging van polyestervezels, films en harsen.
- Ethyleen wordt gebruikt als brandstof voor het lassen en snijden van metalen. Het fungeert ook als rijpingsmiddel voor groenten en fruit.
- Ethyleen is nuttig bij de synthese van verschillende organische verbindingen, waaronder ethanol en aceetaldehyde.
Over het geheel genomen maakt de veelzijdigheid van ethyleen het tot een essentieel onderdeel in een breed scala aan industriële processen, en draagt het bij aan vele aspecten van het moderne leven.
Vragen:
Welke dienen reageren met ethyleen in een Diels-Alder-reactie?
Elk dieen dat twee geconjugeerde dubbele bindingen bevat, kan een Diels-Alder-reactie met etheen ondergaan. Voorbeelden van dergelijke diënen omvatten 1,3-butadieen en isopreen.
Hoe zijn waterstofatomen gerangschikt in etheen?
In etheen zijn de twee koolstofatomen met elkaar verbonden door een dubbele binding. Elk koolstofatoom is ook gebonden aan twee waterstofatomen, waarbij de resterende valenties worden ingenomen door twee ongedeelde elektronenparen op elk koolstofatoom. De rangschikking van atomen rond elke koolstof is trigonaal.
Hoeveel pi-bindingen vormen zich wanneer sp2-hybridisatie plaatsvindt in etheen, C2H4?
Wanneer sp2-hybridisatie plaatsvindt in etheen, wordt er een pi-binding gevormd tussen de twee koolstofatomen. De sp2-hybride orbitalen nemen deel aan de vorming van sigma-bindingen tussen koolstofatomen en waterstofatomen, terwijl de p-orbitalen van elk koolstofatoom elkaar overlappen om de pi-binding te vormen. Ethyleen wordt geclassificeerd als een onverzadigde koolwaterstof omdat het een dubbele binding heeft tussen de twee koolstofatomen. Deze dubbele binding bestaat uit één sigma-binding en één pi-binding, wat betekent dat etheen minder waterstofatomen heeft dan een vergelijkbare verzadigde koolwaterstof met hetzelfde aantal koolstofatomen.
