Ethaan is een koolwaterstof met de chemische formule C2H6. Het wordt vaak gebruikt als brandstof en is een bestanddeel van aardgas. Ethaan heeft twee koolstofatomen en zes waterstofatomen.
| IUPAC-naam | Ethaan |
| Moleculaire formule | C2H6 |
| CAS-nummer | 74-84-0 |
| Synoniemen | Diethyl, dimethyl, ethylhydride, methylmethaan |
| InChi | InChI=1S/C2H6/c1-2/h1-2H3 |
Eigenschappen van ethaan
Ethaan formule
De chemische formule voor ethaan is C2H6. Dit geeft aan dat elk ethaanmolecuul bestaat uit twee koolstofatomen en zes waterstofatomen. De formule helpt ons de samenstelling van ethaan en de structurele opstelling ervan te begrijpen.
Molaire massa van ethaan
De molaire massa van ethylhydride wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. Koolstof heeft een atoommassa van 12,01 g/mol en waterstof heeft een atoommassa van 1,008 g/mol. Door de atoommassa’s te vermenigvuldigen met hun respectievelijke aantallen en ze op te tellen, ontstaat de molaire massa van ethylhydride, die ongeveer 30,07 g/mol bedraagt.
Kookpunt van ethaan
Ethylhydride heeft een kookpunt van -88,6 graden Celsius. Dit betekent dat ethylhydride bij standaard atmosferische druk zal veranderen van een vloeistof in een gas wanneer het tot die temperatuur wordt verwarmd. Kookpunt is een belangrijke eigenschap omdat het de omstandigheden bepaalt waaronder ethylhydride kan worden verdampt.
Smeltpunt van ethaan
Het smeltpunt van ethylhydride is -182,8 graden Celsius. Bij temperaturen onder dit punt bestaat ethylhydride in vaste vorm. Bij verhitting tot deze temperatuur of hoger ondergaat ethylhydride een faseverandering van een vaste naar een vloeibare toestand. Het smeltpunt is cruciaal voor het begrijpen van het fysische gedrag van ethylhydride tijdens koel- of verwarmingsprocessen.
Ethaandichtheid g/ml
De dichtheid van ethylhydride is ongeveer 0,55 g/ml bij standaardtemperatuur en -druk. Dichtheid is een maatstaf voor de hoeveelheid massa die in een bepaald volume aanwezig is. In het geval van ethylhydride vertelt het ons hoe dicht de moleculen zijn verpakt en geeft het inzicht in de fysische eigenschappen ervan.
Molecuulgewicht van ethaan
Het molecuulgewicht van ethylhydride is 30,07 g/mol. Het is de som van de atoommassa’s van alle atomen in één enkel ethylhydridemolecuul. Het molecuulgewicht helpt ons te bepalen hoeveel ethylhydride aanwezig is in een bepaalde massa of volume.
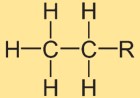
Structuur van ethaan
De structuur van ethylhydride bestaat uit twee koolstofatomen die met elkaar zijn verbonden door een enkele covalente binding. Elk koolstofatoom is omgeven door drie waterstofatomen. De structurele opstelling is lineair, waarbij de waterstofatomen symmetrisch rond de koolstof-koolstofbinding zijn gepositioneerd.
Oplosbaarheid van ethaan
Ethylhydride is niet erg oplosbaar in water. Het is een niet-polair molecuul, terwijl water een polair oplosmiddel is. Niet-polaire moleculen zoals ethylhydride hebben zwakke intermoleculaire krachten en lossen niet gemakkelijk op in polaire oplosmiddelen. Ethylhydride kan echter oplossen in andere niet-polaire oplosmiddelen, zoals hexaan of benzeen.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 1,038 g/l |
| Kleur | N.v.t |
| Geur | Geurloos |
| Molaire massa | 30,07 g/mol |
| Dikte | 0,55 g/ml |
| Fusie punt | -182,8°C |
| Kookpunt | -88,6°C |
| Flitspunt | -135°C |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Oplosbaar in niet-polaire oplosmiddelen |
| Dampdruk | 46,9 psi (bij 21°C) |
| Dampdichtheid | 1,52 (lucht = 1) |
| pKa | ~50 |
| pH | N.v.t |
Veiligheid en gevaren voor ethaan
Ethylhydride brengt verschillende veiligheidsoverwegingen en gevaren met zich mee. Het is licht ontvlambaar en kan met lucht explosieve mengsels vormen. Bij blootstelling aan een vlam of warmtebron kan ethylhydride ontbranden, wat brand of explosies kan veroorzaken. Het is belangrijk om ethylhydride te hanteren en op te slaan in goed geventileerde ruimtes, uit de buurt van ontstekingsbronnen. Ethylhydride vormt ook een verstikkingsgevaar omdat het zuurstof in besloten ruimtes verdringt. Inademing van hoge concentraties ethylhydride kan duizeligheid, misselijkheid en zelfs bewustzijnsverlies veroorzaken. Het is essentieel om geschikte persoonlijke beschermingsmiddelen te gebruiken en veiligheidsprotocollen te volgen bij het werken met of in de buurt van ethylhydride om deze risico’s te beperken.
| Gevarensymbolen | Ontvlambaar gas |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en open vuur. Gebruik in goed geventileerde ruimtes. Hanteer de juiste voorzorgsmaatregelen om het risico van brand of explosie te voorkomen. |
| VN-identificatienummers | UN1035 |
| HS-code | 29011000 |
| Gevarenklasse | 2.1 (ontvlambaar gas) |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Ethaan wordt niet als zeer giftig beschouwd. Inademing van hoge concentraties kan echter verstikking veroorzaken. Gebruiken met voldoende ventilatie en langdurige blootstelling vermijden. |
Methoden voor synthese van ethaan
Verschillende methoden synthetiseren ethylhydride.
Een gebruikelijke methode is het stoomkraakproces, waarbij hoge temperaturen (ongeveer 750 tot 900 ° C) koolwaterstoffen, meestal ethylhydride of zwaardere koolwaterstoffen, verwarmen in aanwezigheid van stoom. Dit proces veroorzaakt reacties zoals thermische ontleding en herschikking, waarbij ethylhydride, ethyleen en propyleen worden geproduceerd.
Een andere methode omvat de katalytische hydrogenering van acetyleen , waarbij acetyleengas reageert met waterstof via geschikte katalysatoren zoals palladium of nikkel, waarbij ethylhydride ontstaat. Deze methode zet selectief zeer reactief en potentieel gevaarlijk acetyleen om in een stabieler en minder reactief ethylhydride.
Ethaan kan ook door cryogene extractie uit aardgas worden gewonnen. Aardgas, voornamelijk methylhydride, wordt onderworpen aan lage temperaturen en hoge drukken om het ethylhydride af te scheiden en terug te winnen. Aardgasverwerkingsfabrieken gebruiken dit proces gewoonlijk om waardevol ethylhydride te extraheren voor verschillende industriële toepassingen.
Bovendien genereren aardolieraffinage en sommige petrochemische processen ethylhydride als bijproduct. Technieken zoals destillatie of absorptie scheiden ethylhydride van andere koolwaterstofstromen.
Over het geheel genomen maken deze synthesemethoden de productie mogelijk van ethylhydride, een cruciale grondstof voor de productie van een breed scala aan chemicaliën, kunststoffen en brandstoffen, die bijdragen aan veel industrieën over de hele wereld.
Gebruik van ethaan
Ethylhydride vindt toepassing in diverse industrieën vanwege de veelzijdige eigenschappen. Hier zijn enkele belangrijke toepassingen van ethylhydride:
- Petrochemische industrie: Ethylhydride is een essentiële grondstof voor de productie van ethyleen, dat als basis dient voor kunststoffen, harsen en synthetische vezels. Het is een sleutelelement bij de productie van polyethyleen, een van de meest gebruikte kunststoffen ter wereld.
- Brandstof en energie: Ethylhydride speelt een rol bij het aandrijven en aandrijven van specifieke industriële processen en is een bestanddeel van aardgas. Industrieën verbranden ethylhydride om warmte of elektriciteit te produceren en dienen als energiebron voor residentiële, commerciële en industriële toepassingen.
- Koeling: In sommige toepassingen, zoals systemen met lage temperaturen, dient ethylhydride als koelmiddel, waardoor efficiënte koelmogelijkheden worden geboden. Het biedt efficiënte koelmogelijkheden en is een alternatief voor andere koelmiddelen met een grotere impact op het milieu.
- Oplosmiddel: Ethylhydride dient als een niet-polair oplosmiddel, vooral in het laboratorium. Ethylhydride vergemakkelijkt processen zoals extractie, zuivering en analyse.
- Kalibratiegas: Ethylhydride dient als component bij de kalibratie van gasmengsels voor gasdetectoren en -analysatoren, waardoor de kalibratie en verificatie van gasdetectieapparatuur mogelijk is.
- Aerosol-drijfgas: Ethylhydride fungeert als aerosol-drijfgas in verschillende producten, waarbij de inhoud uit de container wordt verdreven zodra de druk wordt opgeheven. Het geeft de kracht die nodig is om stoffen zoals cosmetica, verf en huishoudelijke producten te spuiten.
- Chemische synthese: Ethylhydride dient als grondstof voor de synthese van een verscheidenheid aan organische chemicaliën, waaronder ethanol, ethyleenoxide en vinylchloride. Deze chemicaliën vinden toepassing bij de productie van onder meer oplosmiddelen, kunststoffen, schoonmaakmiddelen en PVC-buizen.
Deze uiteenlopende toepassingen benadrukken het belang van ethylhydride in meerdere industrieën, waardoor het een cruciaal element is in de moderne productie en het dagelijks leven.
Vragen:
Vraag: Is C2H6 polair of niet-polair?
A: C2H6 (ethylhydride) is een niet-polair molecuul omdat het verschil in elektronegativiteit tussen koolstof en waterstof klein is, wat resulteert in een uniforme verdeling van de elektronendichtheid.
Vraag: Hoeveel mol koolstofatomen zitten er in 0,500 mol C2H6?
A: In 0,500 mol C2H6 zitten 1,00 mol koolstofatomen, aangezien elk molecuul C2H6 2 koolstofatomen bevat.
Vraag: Wat is de empirische formule voor C2H6?
A: De empirische formule voor C2H6 is CH3, wat de eenvoudigste verhouding van atomen in het molecuul vertegenwoordigt.
Vraag: Wat is C2H6?
A: C2H6 is de chemische formule voor ethylhydride, een gasvormige koolwaterstof die gewoonlijk wordt gebruikt als brandstof en als onderdeel van aardgas.
Vraag: Waarom heeft ethaan (C2H6) geen structurele isomeren?
A: Ethylhydride (C2H6) heeft geen structurele isomeren omdat de koolstofatomen ervan zijn verbonden door een enkele binding, wat resulteert in een lineaire structuur zonder andere mogelijke rangschikking.
Vraag: Heeft C2H6 een waterstofbrug?
A: C2H6 (ethylhydride) heeft geen waterstofbinding omdat het geen waterstofatomen bevat die gebonden zijn aan zeer elektronegatieve elementen zoals stikstof, zuurstof of fluor.
Vraag: Is C2H6 ionisch of covalent?
A: C2H6 is een covalente verbinding omdat deze wordt gevormd door het delen van elektronen tussen koolstof- en waterstofatomen.
Vraag: Is C2H6 oplosbaar in water?
A: C2H6 is onoplosbaar in water omdat het een niet-polair molecuul is en niet gemakkelijk oplost in polair oplosmiddel.
Vraag: Bevat een gasmengsel CH4 en C2H6 in equimolaire verhoudingen?
A: Ja, als het gasmengsel CH4 en C2H6 in equimolaire verhouding bevat, betekent dit dat het aantal mol CH4 gelijk is aan het aantal mol C2H6 in het mengsel.
