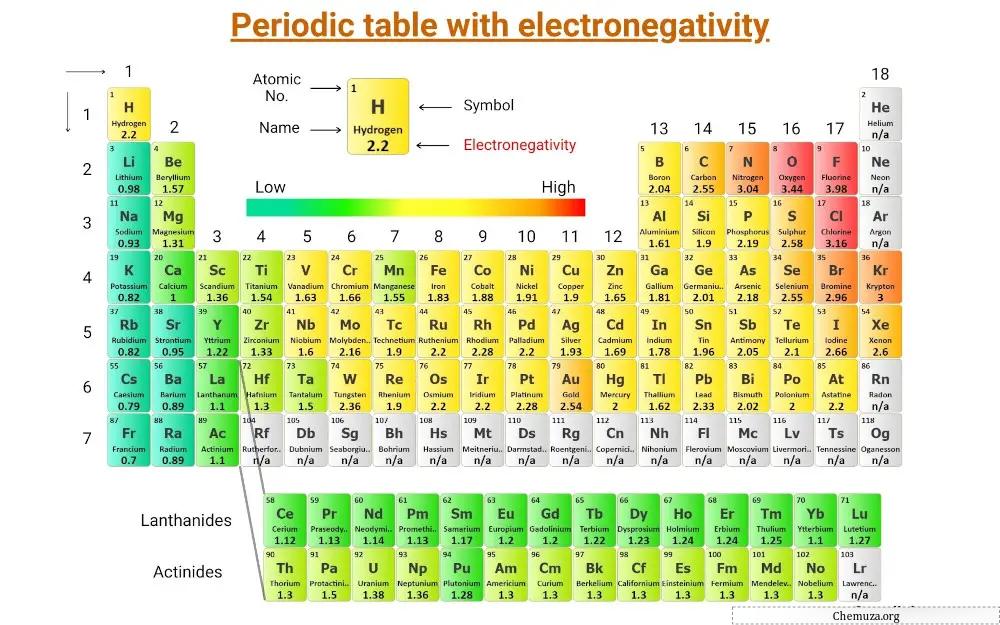
Dit is een periodiek systeem waarop de elektronegativiteit van de elementen wordt vastgelegd.
(Opmerking: Elektronegativiteit heeft geen eenheid. Linus Pauling was een wetenschapper die een elektronegativiteitsschaal ontwierp die elementen ten opzichte van elkaar rangschikt. Deze schaal staat bekend als de elektronegativiteitsschaal van Pauling.) [1]
Als u niet weet wat elektronegativiteit is, vindt u hier een korte uitleg erover.
Wat is elektronegativiteit?
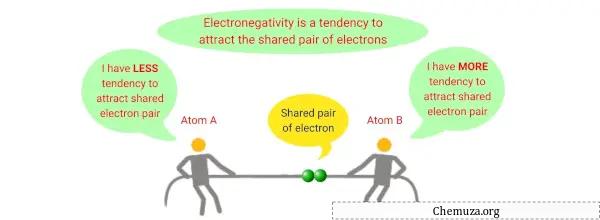
Elektronegativiteit is een chemische eigenschap die het vermogen van een atoom beschrijft om elektronen naar zichzelf toe te trekken wanneer het deel uitmaakt van een verbinding of molecuul.
Het is een maatstaf voor de relatieve aantrekkingskracht die een atoom uitoefent op gedeelde elektronen in een covalente binding .
Waarom is elektronegativiteit belangrijk?
Elektronegativiteit speelt een cruciale rol bij het voorspellen van de aard van chemische bindingen, reactiviteit en fysische eigenschappen van moleculen .
Dit helpt verklaren waarom bepaalde elementen de neiging hebben om specifieke soorten bindingen te vormen, zoals covalente of ionische bindingen, en hoe deze bindingen het gedrag van de resulterende verbinding beïnvloeden.
Elektronegativiteit helpt ook bij het voorspellen van de polariteit van een molecuul en de interacties ervan met andere moleculen, wat belangrijk is op veel gebieden, waaronder de chemie, biologie en materiaalkunde.
Wat betekent hogere elektronegativiteit?
Wanneer een atoom een hogere elektronegativiteit heeft, betekent dit dat het een groter vermogen heeft om elektronen naar zich toe te trekken als het deel uitmaakt van een chemische verbinding of molecuul.
Dit leidt tot de vorming van polaire covalente bindingen, waarbij elektronen niet gelijkelijk tussen atomen worden verdeeld.
Het atoom met de hogere elektronegativiteit trekt elektronen dichter bij zichzelf aan, wat resulteert in een gedeeltelijke negatieve lading, terwijl het andere atoom in de binding een gedeeltelijke positieve lading heeft.
Deze polariteit beïnvloedt de fysische en chemische eigenschappen van de verbinding, zoals het kook- en smeltpunt, de oplosbaarheid en reactiviteit.
Voorbeelden van elementen met hoge elektronegativiteit zijn onder meer fluor, zuurstof en stikstof.
