Dimethylfumaraat (DMF) is een verbinding die medicinaal wordt gebruikt om multiple sclerose te behandelen. Het vermindert het aantal ontstekingen en terugval door het immuunsysteem te moduleren.
| Naam van IUPAC | (E)-but-2-eendizuur-dimethylester |
| Moleculaire formule | C6H8O4 |
| CAS-nummer | 624-49-7 |
| Synoniemen | DMF, Bioban, Fumaderm, Tecfidera, Dimethyl (E)-buteendioaat |
| InChi | InChI=1S/C6H8O4/c1-9-5(7)3-4-6(8)10-2/h3-4H,1-2H3/b4-3+ |
Eigenschappen van dimethylfumaraat
Dimethylfumaraatformule
De chemische formule voor dimethylfumaraat is C6H8O4. Het vertegenwoordigt de specifieke rangschikking en typen atomen die aanwezig zijn in de verbinding, die bestaat uit 6 koolstofatomen (C), 8 waterstofatomen (H) en 4 zuurstofatomen (O). De formule geeft een beknopte weergave van de elementaire samenstelling van dimethylfumaraat.
Dimethylfumaraat molaire massa
De molaire massa van DMF wordt berekend door de atoommassa’s van alle samenstellende elementen op te tellen. Met een molecuulformule van C6H8O4 is de molaire massa ongeveer 144,13 gram per mol. Deze waarde is cruciaal voor verschillende chemische berekeningen en conversies met DMF.
Kookpunt van dimethylfumaraat
DMF heeft een kookpunt van ongeveer 191 graden Celsius (376 graden Fahrenheit). Kookpunt betekent de temperatuur waarbij de vloeibare verbinding overgaat in de gasvormige toestand, en in het geval van DMF gebeurt dit bij die specifieke temperatuur.
Dimethylfumaraat Smeltpunt
Het smeltpunt van DMF is ongeveer 102 graden Celsius (216 graden Fahrenheit). Deze temperatuur vertegenwoordigt het punt waarop de vaste vorm van de verbinding overgaat in de vloeibare toestand. DMF ondergaat deze faseverandering bij het gespecificeerde smeltpunt.
Dichtheid van dimethylfumaraat g/ml
DMF heeft een dichtheid van ongeveer 1,30 gram per milliliter (g/ml). Dichtheid is een maatstaf voor de massa in een specifiek volume van een stof. In het geval van DMF geeft dit de massaconcentratie in elke milliliter van de verbinding aan.
Dimethylfumaraat Molecuulgewicht
Het molecuulgewicht van DMF, ook wel molmassa genoemd, is ongeveer 144,13 gram per mol. Het is de som van de atoomgewichten van alle atomen die aanwezig zijn in een DMF-molecuul. Molecuulgewicht is cruciaal voor verschillende chemische berekeningen en analyses.
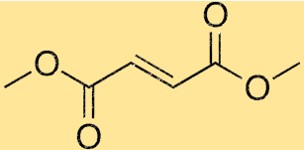
Structuur van dimethylfumaraat
De structuur van DMF bestaat uit twee methylgroepen (CH3) gebonden aan een centrale fumaraatgroep. De fumaraatgroep bestaat uit twee carboxylaatgroepen verbonden door een dubbele binding. Deze opstelling geeft DMF zijn karakteristieke vorm en chemische eigenschappen.
Oplosbaarheid van dimethylfumaraat
DMF is slecht oplosbaar in water, maar lost gemakkelijk op in organische oplosmiddelen zoals ethanol of methanol. Deze beperkte wateroplosbaarheid is een factor waarmee rekening moet worden gehouden bij het werken met DMF en de toepassingen ervan in verschillende industrieën.
| Verschijning | Kleurloze kristallen of wit poeder |
| Soortelijk gewicht | 1u30 |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 144,13 g/mol |
| Dikte | 1,30 g/ml |
| Fusie punt | 102°C (216°F) |
| Kookpunt | 191°C (376°F) |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Slecht oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen (bijv. ethanol, methanol) |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet beschikbaar |
Veiligheid en gevaren van dimethylfumaraat
Om de veiligheid te garanderen moet er voorzichtig met DMF worden omgegaan. Het kan irritatie veroorzaken bij contact met de huid, ogen of luchtwegen. Bij gebruik ervan worden voldoende ventilatie en beschermende uitrusting, zoals handschoenen en een veiligheidsbril, aanbevolen. Inslikken of inademen van DMF moet worden vermeden, omdat dit gezondheidsrisico’s kan veroorzaken. In geval van accidentele blootstelling is onmiddellijke medische hulp noodzakelijk. Het is belangrijk om de juiste opslagrichtlijnen te volgen en het mengsel uit de buurt van open vuur of warmtebronnen te houden. Naleving van veiligheidsprotocollen minimaliseert de risico’s die gepaard gaan met DMF.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd contact met de huid, ogen en luchtwegen. Zorg voor voldoende ventilatie. Draag beschermende uitrusting (handschoenen, bril). Vermijd inslikken en inademen. Zoek onmiddellijk medische hulp als u wordt blootgesteld. Verwijderd houden van open vuur of warmtebronnen. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2917.19.90 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Kan huid- en oogirritatie veroorzaken. Vermijd inslikken en inademen. |
Methoden voor de synthese van dimethylfumaraat
Er zijn verschillende methoden voor het synthetiseren van DMF.
Een gebruikelijke aanpak omvat de verestering van fumaarzuur met behulp van methanol . Bij deze reactie dient zwavelzuur of p-tolueensulfonzuur als de zure katalysator om fumaarzuur met methanol te combineren. De reactie vindt plaats onder refluxomstandigheden, gewoonlijk bij een verhoogde temperatuur, om het veresteringsproces te vergemakkelijken. De zure katalysator bevordert de reactie actief door de verwijdering van water, dat als bijproduct ontstaat, te vergemakkelijken.
Een andere methode omvat de reactie van maleïnezuuranhydride met methanol . Maleïnezuuranhydride en methanol reageren in aanwezigheid van een zure katalysator, zoals zwavelzuur of fosforzuur, om DMF te produceren. De reactie vindt plaats door het openen van de cyclische anhydridering en daaropvolgende verestering.
Om DMF te bereiden kan een omesteringsreactie worden uitgevoerd met behulp van dimethylmaleaat. Bij dit proces reageert dimethylmaleaat met methanol terwijl er een katalysator, zoals natriummethoxide of kaliumhydroxide , aanwezig is. De heresteringsreactie leidt tot de vorming van DMF.
Deze synthesemethoden bieden routes om DMF te verkrijgen in een laboratorium of industriële omgeving. Factoren als efficiëntie, opbrengst en beschikbaarheid van grondstoffen bepalen de keuze voor elke methode, omdat elke methode zijn eigen voordelen heeft. Een goede controle van de reactieomstandigheden en zuiveringsstappen is belangrijk om de gewenste zuiverheid en kwaliteit van het gesynthetiseerde DMF te garanderen.
Gebruik van dimethylfumaraat
DMF vindt toepassingen op verschillende gebieden vanwege de uiteenlopende eigenschappen. Hier zijn enkele toepassingen van DMF:
- Behandeling van multiple sclerose: De FDA heeft DMF goedgekeurd als medicijn voor de behandeling van recidiverende vormen van multiple sclerose. Het helpt het aantal terugvallen en ontstekingen te verminderen door het immuunsysteem te moduleren.
- Farmaceutische industrie: Farmaceutische verbindingen gebruiken DMF als tussenproduct bij hun synthese. Het dient als basis voor de productie van verschillende medicijnen.
- Antimicrobieel middel: DMF vertoont antimicrobiële eigenschappen. Het vindt toepassing als conserveermiddel in producten zoals verven, coatings en lijmen. Het helpt de groei van micro-organismen te remmen en bederf te voorkomen.
- Textielindustrie: De textielindustrie gebruikt DMF als een krachtig biocide om de groei van schimmels op stoffen tijdens opslag en transport te remmen.
- Meubels en lederwaren: Bij de productie van meubels, lederwaren en schoenen gebruiken fabrikanten DMF als schimmelremmer. Het helpt deze items te beschermen tegen microbiële schade tijdens opslag en transport.
- Polymeerstabilisator: DMF werkt als stabilisator en antioxidant in polymeren, zoals polypropyleen en polyethyleen. Dit helpt hun thermische stabiliteit te verbeteren en hun houdbaarheid te verlengen.
- Chemisch reagens: Diverse chemische reacties, waaronder veresteringen en transesterificaties, gebruiken DMF als reagens. Het vergemakkelijkt de synthese van esters en andere organische verbindingen.
Dit zijn slechts enkele voorbeelden van de uiteenlopende toepassingen van DMF in verschillende sectoren. De unieke eigenschappen maken het tot een waardevolle verbinding in de geneeskunde, productie, conservering en chemie.
Vragen:
Vraag: Hoe verwijder ik dimethylfumaraat uit meubels?
A: DMF kan van meubels worden verwijderd door de aangetaste plekken af te vegen met een milde zeepoplossing of door een reinigingsmiddel te gebruiken dat speciaal is ontworpen om vlekken en resten te verwijderen.
Vraag: Wat is meer polair: diethylmaleaat of dimethylfumaraat?
A: DMF is polairder dan diethylmaleaat vanwege de aanwezigheid van elektronenzuigende carbonylgroepen in de structuur.
Vraag: Waar wordt dimethylfumaraat voor gebruikt?
A: DMF wordt gebruikt bij de behandeling van multiple sclerose en vindt ook toepassingen in de farmaceutische industrie, als conserveermiddel, maar ook in de textiel- en polymeerindustrie.
Vraag: Wat zijn de twee functionele groepen die aanwezig zijn in dimethylmaleaat en dimethylfumaraat?
A: Dimethylmaleaat en DMF bevatten beide functionele ester- en alkeengroepen.
Vraag: Kun je allergisch zijn voor de geur van dimethylfumaraat?
A: Ja, sommige mensen kunnen allergische reacties ontwikkelen op de geur van DMF, resulterend in symptomen zoals huidirritatie, ademhalingsproblemen of allergische dermatitis.
Vraag: Zijn dimethylmaleaat en dimethylfumaraat omkeerbaar?
A: Nee, dimethylmaleaat en DMF zijn niet omkeerbaar. Het zijn verschillende isomeren van dezelfde verbinding en worden niet gemakkelijk onderling omgezet.
Vraag: Welke laboratoriumtechniek gaat u gebruiken om het reactieproduct, dimethylfumaraat, te zuiveren?
A: Destillatie wordt gewoonlijk gebruikt om het DMF-reactieproduct te zuiveren door het te scheiden van onzuiverheden op basis van verschillen in kookpunten.
