Diethylether of ethoxyethaan is een kleurloze, licht ontvlambare en vluchtige vloeistof die vaak wordt gebruikt als oplosmiddel en als uitgangsmateriaal voor de synthese van andere organische verbindingen.
| IUPAC-naam | Ethoxyethaan |
| Moleculaire formule | C4H10O |
| CAS-nummer | 60-29-7 |
| Synoniemen | Ether, ethylether, ethyloxide, diethyloxide, 1,1′-oxybisethaan, ether, anesthesie-ether, zwavelzuurether, ethylether |
| InChi | InChI=1S/C4H10O/c1-3-5-4-2/h3-4H2.1-2H3 |
Eigenschappen van diethylether
Dichtheid van diethylether g/ml
De dichtheid van diethylether is 0,713 g/ml. Dichtheid wordt gedefinieerd als de massa van een stof per volume-eenheid. In het geval van diethylether is de dichtheid lager dan die van water, dat een dichtheid heeft van 1 g/ml. Dit betekent dat diethylether op het wateroppervlak drijft.
Molaire massa van diethylether
Diethylether heeft een molaire massa van 74,12 g/mol. Molaire massa is de massa van één mol van een stof, uitgedrukt in grammen. In het geval van ethoxyethaan bevat één mol van de verbinding 74,12 gram. Deze waarde wordt afgeleid van de atoommassa’s van koolstof, waterstof en zuurstof waaruit het molecuul bestaat. De molaire massa van een stof is een belangrijke parameter bij chemische berekeningen, omdat deze wordt gebruikt om de hoeveelheid stof in een bepaald monster te bepalen.
Structuur van diethylether
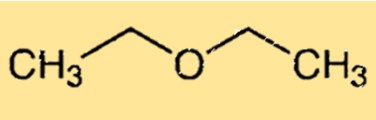
Diethylether heeft een eenvoudige chemische structuur die bestaat uit twee ethylgroepen gebonden aan een zuurstofatoom. Het molecuul heeft een gebogen vorm vanwege het eenzame elektronenpaar op het zuurstofatoom, waardoor het molecuul vervormt ten opzichte van de ideale tetraëdrische geometrie. De gebogen structuur van ethoxyethaan is verantwoordelijk voor het vermogen om waterstofbruggen te vormen met andere moleculen, waardoor het een nuttig oplosmiddel is.
Kookpunt van diethylether
Het kookpunt van diethylether is 34,6°C (94,3°F). Het kookpunt is de temperatuur waarbij een stof bij atmosferische druk overgaat van zijn vloeibare toestand naar zijn gasvormige toestand. Diethylether heeft een relatief laag kookpunt, waardoor het een vluchtige vloeistof is die gemakkelijk verdampt bij kamertemperatuur. Deze eigenschap maakt het nuttig als oplosmiddel en als verdovingsmiddel in de geneeskunde.
Smeltpunt van diethylether
Het smeltpunt van ethoxyethaan is -116,3°C (-177,3°F). Het smeltpunt is de temperatuur waarbij een vaste stof bij atmosferische druk overgaat in een vloeibare toestand. Ethoxyethaan is bij kamertemperatuur een kleurloze vloeistof en vanwege het lage smeltpunt komt het zelden voor dat het in vaste toestand verkeert.
Molecuulgewicht van diethylether
Ethoxyethaan heeft een molecuulgewicht van 74,12 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. Het is een belangrijke parameter bij chemische reacties en stoichiometrie omdat het de hoeveelheid reactant bepaalt die nodig is om een specifieke hoeveelheid product te vormen.
Diethylether-formule
De chemische formule voor ethoxyethaan is C4H10O. Het is samengesteld uit vier koolstofatomen, tien waterstofatomen en één zuurstofatoom. De formule vertegenwoordigt het exacte aantal van elk type atoom in een molecuul en wordt gebruikt om het molecuulgewicht van de stof te bepalen. De chemische formule van een stof is essentieel in chemische vergelijkingen, waar deze wordt gebruikt om reacties in evenwicht te brengen en de hoeveelheid reactanten en producten te bepalen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,713 |
| Kleur | Kleurloos |
| Geur | Zacht, zoals ether |
| Molaire massa | 74,12 g/mol |
| Dikte | 0,713 g/ml |
| Fusie punt | -116,3°C (-177,3°F) |
| Kookpunt | 34,6°C (94,3°F) |
| Flitspunt | -45°C (-49°F) |
| oplosbaarheid in water | 6,9 g/l bij 25°C |
| Oplosbaarheid | Mengbaar met de meeste organische oplosmiddelen |
| Dampdruk | 440 mmHg bij 25°C |
| Dampdichtheid | 2.5 |
| pKa | 15.9 |
| pH | 7 (neutraal) |
Diethylether Veiligheid en gevaren
Ethoxyethaan kent verschillende veiligheids- en gevarenoverwegingen waarmee rekening moet worden gehouden bij de omgang ermee. Het is licht ontvlambaar en kan explosieve damp-luchtmengsels vormen. Daarom moet het uit de buurt van ontstekingsbronnen en vonken worden gehouden. Het kan ook irritatie van de huid, ogen en luchtwegen veroorzaken, en langdurige blootstelling kan duizeligheid en hoofdpijn veroorzaken. Bij het gebruik van ethoxyethaan is voldoende ventilatie noodzakelijk en moeten beschermende uitrusting zoals handschoenen en een veiligheidsbril worden gedragen. Het moet ook op een koele, droge plaats worden bewaard, uit de buurt van oxidatiemiddelen en onverenigbare materialen.
| Gevarensymbolen | F, Xi |
| Beveiligingsbeschrijving | S9, S16, S29, S33, S60, S61 |
| VN-identificatienummers | VN 1155 |
| HS-code | 2909.19.00 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | LD50 (oraal, rat): 3.500 mg/kg |
Methoden voor de synthese van diethylether
Er bestaan verschillende methoden voor het synthetiseren van diethylether, waaronder het laten reageren van ethanol met zwavelzuur en het dehydrateren van de ethanol met behulp van een dehydraterend middel zoals zwavelzuur of aluminiumoxide.
Om ethoxyethaan via de dehydratatiemethode te synthetiseren, verwarm je ethanol met een dehydraterend middel zoals zwavelzuur of aluminiumoxide om een watermolecuul te verwijderen, waardoor ethoxyethaan ontstaat. Om de reactieopbrengst te verbeteren kan een katalysator zoals kaliumhydroxide of natriumhydroxide worden gebruikt.
Een andere methode voor het synthetiseren van ethoxyethaan is het synthetiseren van Williamson-ether, waarbij ethanol reageert met een alkoxide-ion zoals natriumethoxide om ethoxyethaan te vormen. Deze reactie vereist het gebruik van een sterke base en een geschikt oplosmiddel, zoals watervrije ethanol.
Een andere methode om ethoxyethaan te produceren is door de Tishchenko-reactie te gebruiken. Bij dit proces reageren azijnzuur en ethanol in aanwezigheid van een katalysator zoals zwavelzuur of aluminiumoxide, wat resulteert in een hoge opbrengst aan ethoxyethaan.
Om ethoxyethaan als eindproduct te produceren, kan natriumboorhydride of natriumamalgaam worden gebruikt om acetaldehyde te reduceren. Dit is een andere methode voor het synthetiseren van ethoxyethaan. Deze reactie resulteert in de vorming van ethanol , dat vervolgens de hierboven beschreven dehydratatiemethode kan ondergaan om ethoxyethaan te vormen.
Gebruik van diethylether
Sommige toepassingen van diethylether zijn onder meer:
- Oplosmiddel: Een zeer effectief oplosmiddel voor een reeks organische verbindingen, waaronder oliën, vetten, harsen en wassen. Gebruikt bij de productie van lakken, vernissen en andere coatings.
- Verdovingsmiddel: Gebruikt als verdovingsmiddel voor chirurgische ingrepen, hoewel het in de moderne geneeskunde grotendeels is vervangen door veiliger alternatieven.
- Extractie: Gebruikt als extractiemiddel bij de productie van farmaceutische producten, natuurlijke producten en essentiële oliën.
- Brandstofadditief: Wordt gebruikt als brandstofadditief om de prestaties van dieselmotoren te verbeteren, omdat het het cetaangetal van de brandstof kan verhogen.
- Chemisch tussenproduct: Een belangrijk tussenproduct bij de productie van een reeks organische verbindingen, waaronder ethanol, aceetaldehyde en azijnzuur.
- Smaakstof: gebruikt als smaakstof bij de productie van bepaalde voedingsmiddelen en dranken, zoals snoep en likeuren.
- Laboratoriumreagens: Gebruikt als reagens bij laboratoriumexperimenten, vooral in de organische chemie.
- Aerosol-drijfgas: Gebruikt als drijfgas in spuitbussen. Bezorgdheid over de veiligheid leidde tot de geleidelijke stopzetting van dit gebruik.
Vragen:
Vraag: Is diethylether polair?
A: Ja, ethoxyethaan is een polair molecuul vanwege de aanwezigheid van het zuurstofatoom, dat een gedeeltelijke negatieve lading aan het ene uiteinde van het molecuul en een gedeeltelijk positieve lading aan het andere uiteinde creëert.
Vraag: Is diethylether mengbaar met water?
A: Ethoxyethaan is niet erg oplosbaar in water. Het wordt echter als gedeeltelijk watermengbaar beschouwd, wat betekent dat het tot op zekere hoogte met water kan worden gemengd, maar niet volledig.
Vraag: Is diethylether brandbaar?
A: Ja, ethoxyethaan is licht ontvlambaar en kan met lucht explosieve mengsels vormen.
Vraag: Is diethylether polair of niet-polair?
A: Ethoxyethaan is een polair molecuul vanwege de aanwezigheid van het zuurstofatoom.
Vraag: Is diethylether polair aprotisch?
A: Ja, ethoxyethaan wordt beschouwd als een polair aprotisch oplosmiddel, wat betekent dat het polaire moleculen kan oplossen, maar geen waterstofatoom heeft dat kan fungeren als donor van waterstofbruggen.
