Dibasisch natriumfosfaat of Na2HPO4 is een verbinding die in het laboratorium vaak als buffermiddel wordt gebruikt. Het kan ook als voedingsadditief in sommige voedingsmiddelen en dranken worden aangetroffen.
| IUPAC-naam | Dinatriumwaterstoffosfaat |
| Moleculaire formule | Na2HPO4 |
| CAS-nummer | 7558-79-4 |
| Synoniemen | Natriumwaterstoffosfaat, Dinatriumfosfaat, Dibasisch natriumfosfaat, Watervrij dibasisch natriumfosfaat, Dibasisch natriumfosfaat heptahydraat |
| InChi | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Na2HPO4 molaire massa
De molaire massa van dibasisch natriumfosfaat is 141,96 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk van de elementen in de verbinding op te tellen, namelijk natrium (Na), fosfor (P) en zuurstof (O). Molaire massa is een belangrijke parameter die bij verschillende berekeningen wordt gebruikt, bijvoorbeeld om de hoeveelheid van een stof te bepalen die nodig is om een reactie uit te voeren of om een oplossing met een bepaalde concentratie te bereiden.
Dinatriumfosfaatformule
De chemische formule voor dibasisch natriumfosfaat is Na2HPO4. Deze formule vertegenwoordigt de verhouding van elk van de elementen die in de verbinding aanwezig zijn. De formule is belangrijk bij het bepalen van de chemische eigenschappen van de verbinding, zoals de reactiviteit en oplosbaarheid ervan.
Dibasisch kookpunt van natriumfosfaat
Dibasisch natriumfosfaat heeft geen gedefinieerd kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. De ontledingstemperatuur van dibasisch natriumfosfaat zou echter rond de 155°C liggen. Bij temperaturen boven deze waarde begint de verbinding af te breken in de samenstellende ionen, natrium en fosfaat. Deze eigenschap maakt het ongeschikt voor gebruik in toepassingen waarbij verwarming tot hoge temperaturen vereist is.
Smeltpunt van dibasisch natriumfosfaat
Het smeltpunt van Na2HPO4 varieert afhankelijk van de vorm waarin het aanwezig is. De watervrije vorm van de verbinding heeft een smeltpunt van 358°C, terwijl de heptahydraatvorm een lager smeltpunt van 93°C heeft. Smeltpunt is een belangrijke fysische eigenschap die wordt gebruikt om stoffen te identificeren en karakteriseren.
Dibasische dichtheid van natriumfosfaat g/ml
De dichtheid van Na2HPO4 hangt af van de vorm waarin het aanwezig is. De watervrije vorm van de verbinding heeft een dichtheid van 1,7 g/ml, terwijl de heptahydraatvorm een lagere dichtheid heeft van 1,68 g/ml. Dichtheid is een fysieke eigenschap die de hoeveelheid massa beschrijft die zich in een bepaald volume van een stof bevindt.
Dibasisch molecuulgewicht van natriumfosfaat
Het molecuulgewicht van Na2HP04 bedraagt 141,96 g/mol. Deze waarde wordt berekend door de atoommassa’s van elk van de in de verbinding aanwezige elementen op te tellen. Het molecuulgewicht is een belangrijke parameter die bij verschillende berekeningen wordt gebruikt, bijvoorbeeld om de hoeveelheid van een stof te bepalen die nodig is om een reactie uit te voeren of om een oplossing met een bepaalde concentratie te bereiden.
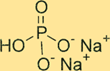
Dibasische structuur van natriumfosfaat
Na2HPO4 heeft een kristalstructuur. De watervrije vorm van de verbinding is een wit, geurloos poeder, terwijl de heptahydraatvorm een kleurloos, transparant kristal is. De verbinding heeft een tetraëdrische vorm rond het fosforatoom, waarbij elk zuurstofatoom zich op de hoeken van de tetraëder bevindt. Natriumionen bevinden zich in de interstitiële ruimtes tussen de tetraëders.
| Verschijning | Wit poeder of transparante kristallen |
| Soortelijk gewicht | 1,68 – 1,7 g/ml |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 141,96 g/mol |
| Dikte | 1,68 – 1,7 g/ml |
| Fusie punt | Watervrij: 358°C, heptahydraat: 93°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in ethanol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | 2,15 (fosfaation) |
| PH | 8,0 – 11,0 (0,1 M waterige oplossing) |
Veiligheid en gevaren van dibasisch natriumfosfaat
Dibasisch natriumfosfaat (Na2HPO4) wordt over het algemeen als veilig beschouwd voor gebruik in een verscheidenheid aan toepassingen, maar het kan huid- en oogirritatie veroorzaken. Inademing van de verbinding in poedervorm kan irritatie van de luchtwegen veroorzaken. Na2HPO4 kan heftig reageren met sterke zuren en oxidatiemiddelen en kan bij verhitting tot hoge temperaturen giftige dampen vrijgeven. Zoals bij alle chemicaliën moeten bij het hanteren van deze verbinding passende voorzorgsmaatregelen worden genomen, zoals het dragen van beschermende kleding en handschoenen en het werken in een goed geventileerde ruimte. Bij contact met de huid of ogen, overvloedig spoelen met water en indien nodig een arts raadplegen.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S22 – stof niet inademen, S24 – contact met de huid vermijden, S37 – geschikte handschoenen dragen |
| AN-identificaties | UN3077 |
| HS-code | 28352200 |
| Gevarenklasse | 9 |
| Verpakkingsgroep | III |
| Toxiciteit | LD50 (rat, oraal) – 3.400 mg/kg |
Methoden voor de synthese van dibasisch natriumfosfaat
Dibasisch natriumfosfaat (Na2HPO4) kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van fosforzuur met natriumhydroxide, de neutralisatie van fosforzuur met natriumcarbonaat of -bicarbonaat, en de reactie van monobasisch natriumfosfaat met natriumhydroxide.
- Een gebruikelijke methode is om fosforzuur te laten reageren met natriumhydroxide in een verhouding van 1:2 om Na2HPO4 en water te produceren. De reactie kan worden uitgevoerd bij kamertemperatuur of onder zachte verwarming, en het resulterende product wordt gezuiverd door kristallisatie of verdamping.
- Een andere methode is het neutraliseren van het fosforzuur met natriumcarbonaat of bicarbonaat, gevolgd door precipitatie van Na2HPO4. De pH van het reactiemengsel wordt met behulp van natriumcarbonaat of bicarbonaat op ongeveer 8-9 ingesteld, en het resulterende neerslag wordt verzameld en gewassen met water om eventuele onzuiverheden te verwijderen.
- Een derde methode omvat het laten reageren van monobasisch natriumfosfaat met natriumhydroxide in een verhouding van 1:1, resulterend in de vorming van Na2HPO4 en water. Het resulterende product wordt vervolgens gezuiverd door kristallisatie of verdamping.
De keuze voor de methode is afhankelijk van factoren als gewenste zuiverheid, opbrengst en kosteneffectiviteit. De synthese van Na2HPO4 kan op verschillende manieren worden uitgevoerd, die elk hun eigen voordelen en beperkingen hebben.
Gebruik van dibasisch natriumfosfaat
Dibasisch natriumfosfaat heeft vele toepassingen in verschillende industrieën.
- De voedingsindustrie gebruikt het als emulgator, buffer en verdikkingsmiddel. Het werkt als een sequestreermiddel en helpt de voedselkwaliteit en -stabiliteit te behouden door te voorkomen dat metaalionen reageren met andere voedselcomponenten. Het dient als vertrekkend middel in bakpoeder en als pH-regelaar in zuivelproducten.
- De medische industrie gebruikt het als laxeermiddel om constipatie te behandelen door het watergehalte van de dikke darm te verhogen. Het wordt ook gebruikt bij de bereiding van medicijnen en injecties als pH-regelaar en buffer.
- In de agrarische sector fungeert het als meststof en levert het fosfor aan planten.
- Het functioneert ook als voedingssupplement in diervoeding.
- De waterbehandelingsindustrie gebruikt Na2HPO4 als corrosieremmer en kalkremmer in ketels en koelsystemen.
- Het werkt als reinigingsmiddel en verwijdert kalk- en magnesiumaanslag van oppervlakken.
Vragen:
Vraag: Is dibasisch natriumfosfaat een conserveermiddel?
A: Na2HPO4 wordt over het algemeen niet gebruikt als conserveermiddel in voedingsproducten. Het kan echter fungeren als een bindmiddel, wat de kwaliteit en stabiliteit van voedsel kan helpen behouden door te voorkomen dat metaalionen reageren met andere voedselcomponenten.
Vraag: Hoeveel mol dibasisch natriumfosfaat (mw 141,98) zit er in 50 ml van een 20% w/v oplossing?
A: Om het aantal mol in een 20% w/v oplossing van Na2HPO4 te berekenen, moeten we eerst het gewicht/volume-percentage omrekenen naar gram/100 ml. Een oplossing van 20% w/v betekent 20 gram verbinding in 100 ml oplossing. Daarom bevat 50 ml oplossing 10 gram Na2HPO4. Om het aantal mol te berekenen, deelt u de massa door het molecuulgewicht:
mol = massa / molecuulgewicht mol = 10 g / 141,98 g/mol mol = 0,070 mol
Daarom zit er 0,070 mol Na2HPO4 in 50 ml van een 20% w/v-oplossing.
Vraag: Wat is de dichtheid van dibasisch natriumfosfaat?
A: De dichtheid van Na2HPO4 hangt af van de vorm en concentratie van de verbinding. De watervrije vorm heeft een dichtheid van ongeveer 2,36 g/cm³, terwijl de heptahydraatvorm een dichtheid heeft van ongeveer 1,62 g/cm³. In oplossing zal de dichtheid variëren afhankelijk van de concentratie.
