Het carbonaation, CO32-, is een negatief geladen ion dat bestaat uit één koolstofatoom, drie zuurstofatomen en een totale lading van -2. Het wordt vaak aangetroffen in mineralen zoals calciet en dolomiet, maar ook in waterige oplossingen als bicarbonaat. Het speelt een cruciale rol bij het beheersen van de pH-waarde in de oceaan en andere waterlichamen.
| IUPAC-naam | Carbonaat-ion |
| Moleculaire formule | CO32- |
| CAS-nummer | 497-19-8 |
| Synoniemen | Koolzuur, Kooltrioxide |
| InChi | InChI=1S/CH2O3,2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Eigenschappen van carbonaationen
Carbonaatformule
De formule voor het carbonaation wordt weergegeven door CO3^2-, waarbij C koolstof vertegenwoordigt, O zuurstof vertegenwoordigt en het symbool 2- de negatieve lading van het ion vertegenwoordigt. Deze formule geeft aan dat er drie zuurstofatomen en één koolstofatoom in het carbonaation zitten, waardoor het zijn karakteristieke moleculaire structuur krijgt.
CO3-carbonaatlading
Het carbonaation, CO3^2-, heeft een negatieve lading 2 vanwege de aanwezigheid van drie zuurstofatomen en één koolstofatoom in de chemische formule. De negatieve lading is het gevolg van de aanwezigheid van extra elektronen in het carbonaation, waardoor het een negatief geladen ion wordt.
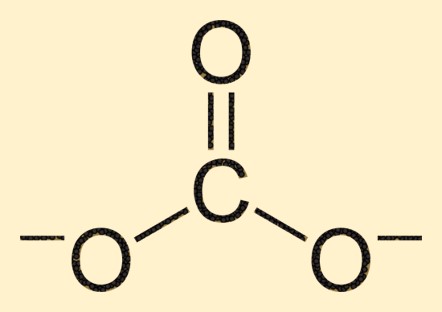
Carbonaat structuur
Het carbonaation bestaat uit een koolstofatoom in het midden, omgeven door drie zuurstofatomen in een trigonale vlakke opstelling. Het koolstofatoom vormt een dubbele binding met een zuurstofatoom, terwijl de andere twee zuurstofatomen via enkele bindingen aan het koolstofatoom zijn gekoppeld. Deze structuur geeft het CO3 2- ion zijn karakteristieke vorm en eigenschappen.
Carbonaation Molecuulgewicht
Het molecuulgewicht van het carbonaation is ongeveer 60,01 g/mol, berekend op basis van de atoomgewichten van de samenstellende elementen (koolstof, zuurstof). Het molecuulgewicht van koolzuur is belangrijk bij het bepalen van de hoeveelheid koolzuur in een monster, evenals bij het bepalen van de fysische en chemische eigenschappen ervan.
| Verschijning | Stevig wit poeder |
| Soortelijk gewicht | 2.5 |
| Kleur | Wit |
| Geur | Geen |
| Molaire massa | 100,09 g/mol |
| Dikte | 2,83 g/cm3 |
| Fusie punt | 825°C |
| Kookpunt | 1484°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar in water |
| Oplosbaarheid | Oplosbaar in zuren |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | 10:33 uur |
| PH | 8.6 |
Veiligheid en gevaren van carbonaationen
Het carbonaation, CO32-, wordt veel gebruikt in verschillende industrieën, maar er moet voorzichtig mee worden omgegaan. Het inademen van grote hoeveelheden carbonaatstof kan ademhalingsproblemen veroorzaken, terwijl het innemen van grote hoeveelheden spijsverteringsproblemen kan veroorzaken. Contact met de huid kan irritatie en huidletsels veroorzaken. Het is ook brandbaar en kan reageren met andere chemicaliën, waardoor gevaarlijke gassen ontstaan. Het is belangrijk om veiligheidsmaatregelen te volgen, zoals het dragen van persoonlijke beschermingsmiddelen en het opslaan van carbonaationen in geschikte containers, om het risico op ongelukken te minimaliseren.
| Gevaar symbool | Geen |
| Beveiligingsbeschrijving | Het wordt niet als gevaarlijk beschouwd en is niet geassocieerd met specifieke gevarensymbolen. |
| EEN ID | N.v.t |
| HS-code | N.v.t |
| Gevarenklasse | N.v.t |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Niet giftig |
Methoden voor carbonaationsynthese
Carbonaationen (CO3 2- ) kunnen op verschillende manieren worden gesynthetiseerd. De meest gebruikelijke methode om CO3 2- ionen te produceren is door koolstofdioxide en water te laten reageren. Deze reactie produceert een koolzuuroplossing, die vervolgens kan worden geneutraliseerd met een alkali, zoals natriumhydroxide, om koolzuur te produceren. Koolzuur kan ook worden geproduceerd door elektrolyse van een zoutoplossing, waarbij zich carbonaationen vormen aan de kathode. Deze ionen kunnen in het laboratorium ook worden geproduceerd door een chemische reactie tussen een zuur en een carbonaatzout.
Gebruik van carbonaationen
Industrieën gebruiken koolzuur op grote schaal voor verschillende doeleinden. Fabrikanten van bakpoeder, producenten van maagzuurremmers en drankenbedrijven verwerken gewoonlijk koolzuur in hun producten. De waterbehandelingsindustrie controleert de pH-waarden in drinkwater en zwembaden met behulp van carbonaationen. De bouwsector gebruikt CO3 2- ionen als hoofdbestanddeel van cement om beton te maken. Boeren voegen carbonaationen toe aan de bodem om de alkaliteit ervan te verbeteren en de groei van gewassen te bevorderen. De chemische industrie gebruikt carbonaationen als katalysator en reagens bij verschillende chemische reacties. De voedingsindustrie conserveert voedsel door carbonaationen op te nemen. Vanwege hun veelzijdigheid spelen carbonaationen een essentiële rol in veel alledaagse producten en industriële processen.
