Chloortrifluoride of ClF3 is een zeer reactieve en giftige chemische verbinding die wordt gebruikt in raketbrandstoffen, schoonmaakmiddelen en als oxidatiemiddel bij chemische reacties. Het kan ernstige brandwonden veroorzaken en spontaan ontbranden bij contact met organische materialen.
| IUPAC-naam | Chloortrifluoride |
| Moleculaire formule | ClF3 |
| CAS-nummer | 7790-91-2 |
| Synoniemen | Chloorfluoride, Trifluorchloor, Trichloorfluoride, Fluorchloor, Chloorfluoride, Fluorchloride |
| InChi | InChI=1S/ClF3/c2-1(3)4 |
Chloortrifluoride-formule
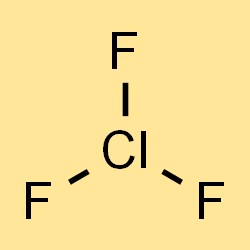
De chemische formule voor chloortrifluoride is ClF3, wat de drie fluoratomen en één chlooratoom in het molecuul vertegenwoordigt. De formule kan worden gebruikt om de molaire massa, dichtheid en andere fysische eigenschappen van chloortrifluoride te berekenen. De formule geeft ook de typen en het aantal atomen aan die in de verbinding aanwezig zijn, wat belangrijk is voor het begrijpen van de chemische eigenschappen en reactiviteit ervan.
Chloortrifluoride molaire massa
De molaire massa van chloortrifluoride (ClF3) is 92,45 g/mol. Deze waarde wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen, namelijk 35,45 g/mol voor chloor en 37,996 g/mol voor fluor. De molaire massa van chloortrifluoride is belangrijk bij chemische berekeningen en bij het bepalen van de hoeveelheid van de verbinding in een bepaald monster.
Kookpunt van chloortrifluoride
Chloortrifluoride heeft een kookpunt van 11,75°C bij standaarddruk. Dit maakt het een vluchtige en zeer reactieve verbinding die gemakkelijk kan verdampen en giftige dampen kan vormen. Het lage kookpunt van chloortrifluoride wordt toegeschreven aan de zwakke intermoleculaire krachten tussen de moleculen, waardoor ze bij relatief lage temperaturen uit elkaar kunnen vallen en als gas kunnen ontsnappen.
Smeltpunt van chloortrifluoride
Chloortrifluoride heeft een smeltpunt van -76,3°C (-105,3°F) bij standaarddruk. Dit maakt het een vaste stof bij kamertemperatuur en druk, maar kan vanwege zijn hoge vluchtigheid gemakkelijk sublimeren en giftige dampen vormen. Het lage smeltpunt van chloortrifluoride wordt toegeschreven aan de zwakke intermoleculaire krachten tussen de moleculen, waardoor ze bij relatief lage temperaturen uit elkaar kunnen vallen en een gas kunnen worden.
Dichtheid van chloortrifluoride g/ml
De dichtheid van chloortrifluoride is 1,77 g/ml bij standaardtemperatuur en druk (STP). Deze waarde is hoger dan die van lucht (1,29 g/ml), waardoor chloortrifluoride een dichter gas is dan lucht. De hoge dichtheid van chloortrifluoride is te danken aan het molecuulgewicht, dat hoger is dan dat van de meeste gassen in de atmosfeer.
Molecuulgewicht van chloortrifluoride
Het molecuulgewicht van chloortrifluoride is 92,45 g/mol. Deze waarde wordt berekend door de atoomgewichten van de samenstellende elementen op te tellen, namelijk 35,45 g/mol voor chloor en 37,996 g/mol voor fluor. Het hoge molecuulgewicht van chloortrifluoride maakt het een dicht gas, zwaarder dan lucht.
Structuur van chloortrifluoride
Chloortrifluoride heeft een trigonale bipiramidale moleculaire geometrie, met een centraal chlooratoom gebonden aan drie fluoratomen in equatoriale posities en twee lege plaatsen in axiale posities. Deze structuur geeft aanleiding tot een polair molecuul, waarbij de twee axiale posities een gedeeltelijk positieve lading hebben en de drie equatoriale posities een gedeeltelijk negatieve lading hebben.
| Verschijning | Kleurloos tot lichtgeel gas of vloeistof |
| Soortelijk gewicht | 1,77 |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Scherpe en verstikkende geur |
| Molaire massa | 92,45 g/mol |
| Dikte | 1,77 g/ml bij STP |
| Fusie punt | -76,3°C (-105,3°F) |
| Kookpunt | 11,75°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert hevig met water |
| Oplosbaarheid | Oplosbaar in zwavelzuur, salpeterzuur en andere oxidatiemiddelen |
| Dampdruk | 1,73 ATM bij 20°C |
| Dampdichtheid | 3,2 (lucht = 1) |
| PKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van chloortrifluoride
Chloortrifluoride is een zeer reactieve en gevaarlijke verbinding. Dit brengt ernstige gezondheids- en veiligheidsrisico’s met zich mee en moet met uiterste voorzichtigheid worden behandeld. Het kan ernstige brandwonden, corrosie en irritatie veroorzaken bij contact met de huid, ogen en slijmvliezen. Inademing van de dampen kan ademhalingsproblemen, hoesten en pijn op de borst veroorzaken. Chloortrifluoride kan ook ontbranden en heftig reageren met organische materialen, metalen en water, waardoor explosies en branden kunnen ontstaan. Bij het hanteren van chloortrifluoride moet gespecialiseerde beschermingsmiddelen worden gedragen, zoals chemicaliënbestendige pakken en ademhalingstoestellen, en deze mogen alleen worden gebruikt in een goed geventileerde omgeving die wordt gecontroleerd door opgeleide professionals.
| Gevarensymbolen | Bijtend, oxiderend |
| Beveiligingsbeschrijving | Verwijderd houden van hitte, vonken, open vuur, hete oppervlakken en ontstekingsbronnen. Draag beschermende kleding en uitrusting. Vermijd contact met huid, ogen en kleding. Adem geen dampen of dampen in. Niet inslikken. Alleen in een goed geventileerde ruimte gebruiken. |
| AN-identificaties | Een 1749 |
| HS-code | 281211 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | I |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van chloortrifluoride
Directe fluorering van chloorgas kan chloortrifluoride synthetiseren. Waterstoffluoride en chloorgas kunnen reageren om chloortrifluoride te synthetiseren.
Een mengsel van chloorgas en fluorgas reageert bij hoge temperatuur op een bed van actieve kool of ander inert materiaal om chloortrifluoride te produceren bij de directe fluoreringsmethode.
Een andere methode omvat de reactie tussen waterstoffluoride en chloorgas. Bij deze methode passeren beide gassen bij verhoogde temperaturen een katalysator, zoals geactiveerd aluminiumoxide of platina. De reactie tussen de twee gassen produceert chloortrifluoride en waterstofchloride als bijproducten.
Zwaveltetrafluoride en chloorgas reageren in aanwezigheid van een katalysator, zoals ijzer of nikkel, bij verhoogde temperaturen om chloortrifluoride te synthetiseren en zwaveldioxide als bijproduct te produceren.
Voor elk van deze methoden zijn gespecialiseerde apparatuur en zorgvuldige omgang vereist vanwege de gevaarlijke aard van chloortrifluoride. De veiligheid van personeel en milieu moet tijdens het syntheseproces worden gewaarborgd door passende veiligheidsmaatregelen, zoals chemisch bestendige pakken en ventilatiesystemen.
Gebruik van chloortrifluoride
Chloortrifluoride (ClF3) heeft verschillende industriële toepassingen vanwege zijn zeer reactieve karakter en sterke oxiderende eigenschappen.
- ClF3 reinigt en etst halfgeleidermaterialen zoals silicium en germanium door ongewenste verontreinigingen en onzuiverheden van hun oppervlakken te verwijderen.
- ClF3 zet uraniumoxide om in uraniumhexafluoride voor de productie van nucleaire brandstof. Uraniumhexafluoride is verrijkt voor gebruik in kernreactoren.
- ClF3 verhoogt de verbrandingsefficiëntie en genereert meer stuwkracht bij gebruik in combinatie met andere oxidatiemiddelen zoals hydrazine of waterstof in raketbrandstoffen en hoogenergetische oxidatiemiddelen voor brandstofsystemen.
- ClF3 maakt textiel- en papierproducten wit.
- ClF3 produceert bepaalde chemicaliën zoals fluorgas en fluorkoolwaterstoffen.
Vanwege de gevaarlijke aard ervan moet chloortrifluoride bij al zijn toepassingen met uiterste voorzichtigheid worden gehanteerd, en alleen door opgeleide professionals met de juiste veiligheidsuitrusting en protocollen.
Vragen:
Vraag: Is chloortrifluoride polair of niet-polair?
A: Chloortrifluoride is een polair molecuul vanwege het verschil in elektronegativiteit tussen chloor- en fluoratomen.
Vraag: Hoe chloortrifluoride blussen?
A: Chloortrifluoride kan worden geblust met droog zand, grafiet of natriumchloride. Er mag nooit water worden gebruikt om een chloortrifluoridebrand te blussen, omdat dit heftig kan reageren en giftige gassen kan vrijkomen.
Vraag: Lewis-structuur van chloortrifluoride?
A: De Lewis-structuur van ClF3 bestaat uit een centraal chlooratoom omgeven door drie fluoratomen. Het chlooratoom is met elk van de drie fluoratomen verbonden door een enkele binding, en er bevindt zich een enkel elektronenpaar op het chlooratoom.
Vraag: Wat is de formele lading van het chlooratoom in het chloortrifluoridemolecuul?
A: De formele lading van het chlooratoom in chloortrifluoride is nul. Het chlooratoom heeft zeven valentie-elektronen en is gebonden aan drie fluoratomen, die een hogere elektronegativiteit hebben dan chloor. Het eenzame elektronenpaar op het chlooratoom is niet betrokken bij enige binding en wordt daarom niet in aanmerking genomen bij het bepalen van de formele lading.
Vraag: Chloortrifluoridebrand?
A: Chloortrifluoride is een zeer reactieve en brandbare stof die spontaan kan ontbranden bij contact met organische materialen of zelfs lucht. In het geval van een brand met chloortrifluoride moet droog zand, grafiet of natriumchloride worden gebruikt om de brand te blussen. Er mag nooit water worden gebruikt, omdat dit een gewelddadige reactie kan veroorzaken. Het evacueren van het gebied en het inroepen van onmiddellijke medische hulp als het wordt blootgesteld, is ook van cruciaal belang in het geval van een chloortrifluoridebrand.
