Chroomzuur is een sterk, bijtend oxidatiemiddel dat wordt gebruikt in een verscheidenheid aan toepassingen, zoals het reinigen van metaal, graveren en in sommige laboratoriumexperimenten. Het is rood van kleur.
| IUPAC-naam | Chroomzuur |
| Moleculaire formule | H2CrO4 |
| CAS-nummer | 7738-94-5 |
| Synoniemen | Chroom (VI) zuur, chroomzuur, dihydroxydioxydochroom, diwaterstof (tetraoxydochromaat) |
| InChi | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Eigenschappen van chroomzuur
Chroomzuurformule
De chemische formule voor chroomzuur is H2CrO4. Het bestaat uit twee waterstofatomen, één chroomatoom en vier zuurstofatomen. De formule vertegenwoordigt de samenstelling van chroomzuur op moleculair niveau.
Chroomzuur molaire massa
De molaire massa van chroomzuur kan worden berekend door de atoommassa’s van de samenstellende elementen bij elkaar op te tellen. Chroom heeft een atoommassa van 51,996 gram per mol, waterstof heeft een molaire massa van 1,008 gram per mol en zuurstof heeft een molaire massa van 16,00 gram per mol. Daarom is de molaire massa van chroomzuur ongeveer 118,00 gram per mol.
Kookpunt van chroomzuur
Chroomzuur heeft geen duidelijk kookpunt, omdat het bij verhitting ontleedt, waarbij zuurstofgas vrijkomt. De ontledingstemperatuur ligt echter rond de 190°C (374°F). Bij verhitting ondergaat chroomzuur een chemische reactie die resulteert in de vorming van chroomtrioxide en water.
Smeltpunt van chroomzuur
Het smeltpunt van chroomzuur is niet goed gedefinieerd vanwege de neiging om te ontleden voordat het smelt. Het is echter bekend dat chroomzuur kan ontbinden rond de 250°C (482°F) of zelfs lagere temperaturen, afhankelijk van de omstandigheden.
Dichtheid van chroomzuur g/ml
Chroomzuur heeft een dichtheid van ongeveer 1,2 gram per milliliter (g/ml) bij kamertemperatuur. Deze dichtheidswaarde geeft aan dat chroomzuur relatief dicht is in vergelijking met water.
Chroomzuurmolecuulgewicht
Het molecuulgewicht van chroomzuur wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. In dit geval bedraagt het molecuulgewicht ongeveer 118,00 gram per mol.
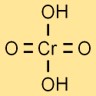
Structuur van chroomzuur
De structuur van chroomzuur wordt weergegeven door een centraal chroomatoom gebonden aan vier zuurstofatomen en twee waterstofatomen. De zuurstofatomen zijn in een tetraëdrische vorm rond het chroomatoom gerangschikt.
Oplosbaarheid van chroomzuur
Chroomzuur is matig oplosbaar in water, wat betekent dat het tot op zekere hoogte kan oplossen. De oplosbaarheid neemt toe bij toenemende temperatuur. Er moet echter voorzichtig mee worden omgegaan, omdat het een bijtende stof is.
| Verschijning | Donkerrode kristallen |
| Soortelijk gewicht | 2,70 |
| Kleur | Rood |
| Geur | Geurloos |
| Molaire massa | 118,01 g/mol |
| Dikte | 1.201 g/ml |
| Fusie punt | Ontleedt bij ~190°C |
| Kookpunt | Ontleedt bij ~250°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water en organische oplosmiddelen zoals ethanol, ether |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | -0,64 |
| pH | Zeer zuur (pH < 1) |
Veiligheid en gevaren van chroomzuur
Chroomzuur brengt verschillende veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het is een bijtende stof die bij contact ernstige brandwonden aan de huid, ogen en luchtwegen kan veroorzaken. Inademing van chroomzuurdampen of -nevels kan de luchtwegen irriteren en hoesten, kortademigheid en longschade veroorzaken. Het is ook zeer giftig als het wordt ingeslikt en veroorzaakt buikpijn, braken en mogelijke orgaanschade. Bovendien is chroomzuur een sterk oxidatiemiddel en kan het heftig reageren of brandbare stoffen doen ontbranden. Bij het werken met chroomzuur moeten geschikte beschermende uitrustingen worden gedragen, zoals handschoenen, een veiligheidsbril en een laboratoriumjas, en deze moeten worden opgeslagen en afgevoerd volgens de veiligheidsvoorschriften.
| Gevarensymbolen | Bijtend, oxiderend |
| Beveiligingsbeschrijving | – Veroorzaakt ernstige brandwonden – Kan intensieve brand veroorzaken; oxidatiemiddel – Schadelijk bij inslikken – Veroorzaakt irritatie van de luchtwegen – Veroorzaakt oogletsel – Kan genetische defecten veroorzaken – Kan kanker veroorzaken – Kan de vruchtbaarheid of het ongeboren kind schaden – Zeer giftig voor in het water levende organismen – Op de juiste manier hanteren en afvoeren |
| VN-identificatienummers | UN1755, UN1463 |
| HS-code | 28191000 |
| Gevarenklasse | 8 (corrosief) |
| Verpakkingsgroep | II (gemiddeld) |
| Toxiciteit | Zeer giftig en schadelijk |
Chroomzuursynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van chroomzuur.
Een veelgebruikte methode is de reactie tussen natriumdichromaat (Na2Cr2O7) en zwavelzuur (H2SO4) . Hierbij voeg je al roerend langzaam natriumdichromaat toe aan het zwavelzuur. De reactie verloopt en vormt chroomzuur (H2CrO4) en natriumsulfaat (Na2SO4) als bijproduct. De resulterende chroomzuuroplossing kan worden gezuiverd en geconcentreerd door overtollig water te verwijderen.
Net als bij de vorige methode kunnen we kaliumchromaat aan zwavelzuur toevoegen, wat resulteert in de vorming van chroomzuur en kaliumsulfaat (K2SO4) als bijproduct.
Als alternatief kunt u chroomzuur bereiden door chroomtrioxide (CrO3) te laten reageren met water. Chroomtrioxide los je op in water, waardoor er een chroomzuuroplossing ontstaat.
Bedenk dat chroomzuur een zeer bijtende en gevaarlijke stof is. Daarom moet de synthese ervan worden uitgevoerd met passende veiligheidsmaatregelen en in een goed geventileerde ruimte. Draag tijdens het syntheseproces beschermende uitrusting, zoals handschoenen, een veiligheidsbril en een laboratoriumjas. Volg ook de juiste verwijderingsmethoden om de veilige verwerking en verwijdering van afval dat tijdens de synthese ontstaat te garanderen.
Gebruik van chroomzuur
Chroomzuur vindt verschillende toepassingen vanwege zijn eigenschappen als krachtig oxidatiemiddel. Hier zijn enkele veelvoorkomende toepassingen:
- Metaalreiniging: Chroomzuur verwijdert effectief roest, kalk en organische afzettingen van metalen oppervlakken, waardoor oppervlakteverontreinigingen worden gereinigd en verwijderd.
- Etsen: Chroomzuur creëert fijne patronen en ontwerpen op oppervlakken, zoals glas, keramiek en metalen, waardoor deze worden geëtst en nuttig worden gemaakt bij de productie van decoratief glaswerk en de vervaardiging van elektronische schakelingen.
- Oppervlaktevoorbereiding: Bij industriële processen wordt chroomzuur gebruikt om oppervlakken voor te bereiden voor schilderen, coaten of verlijmen, waardoor een goede hechting wordt gegarandeerd door onzuiverheden te verwijderen en een schoon oppervlak te creëren.
- Analytische chemie: Chemici en laboratoria gebruiken chroomzuur als oxidatiemiddel bij chemische analyses en laboratoriumexperimenten, waarbij de concentraties van bepaalde organische verbindingen worden bepaald.
- Houtverduurzaming: Chroomzuur werkt als houtverduurzamingsmiddel en dringt diep door in de houtvezels om het te beschermen tegen rot, insectenplagen en verwering.
- Textielindustrie: De textielindustrie gebruikt chroomzuur voor verf- en drukprocessen, het fixeren van kleurstoffen in stoffen en het verbeteren van de kleurechtheid.
- Fotografie: Chroomzuur speelt een rol bij bepaalde fotografische processen, waaronder de productie van kleurenafdrukken en kleuromkeerfilm.
- Galvaniseren: Bij galvaniseerprocessen, vooral bij verchromen, dient chroomzuur als een bron van chroomionen die op metalen oppervlakken worden afgezet, waardoor een beschermende en decoratieve coating ontstaat.
Het is belangrijk op te merken dat chroomzuur een gevaarlijke stof is en dat er passende veiligheidsmaatregelen moeten worden genomen bij het hanteren, opslaan en weggooien ervan.
Vragen:
Vraag: Wat gebeurt er als fenol wordt geoxideerd met chroomzuur?
A: Fenol ondergaat oxidatie met chroomzuur, wat resulteert in de vorming van chinonen en water.
Vraag: Hoe chroomzuur bereiden?
A: Chroomzuur kan worden bereid door natriumdichromaat of kaliumchromaat te laten reageren met zwavelzuur.
Vraag: Hoe chroomzuur maken?
A: Chroomzuur kan worden gemaakt door een chroomverbinding (zoals chroomtrioxide) met water te mengen.
Vraag: Wat is chroomzuur?
A: Chroomzuur is een sterk en bijtend oxidatiemiddel dat bestaat uit chroom, waterstof en zuurstof.
Vraag: Vermindert chroomzuur alkenen?
A: Nee, chroomzuur is een oxidatiemiddel en heeft geen reducerende eigenschappen.
Vraag: Hoe chroomzuur bereiden om laboratoriumglaswerk te reinigen?
A: Een chroomzuurreinigingsoplossing kan worden gemaakt door chroomtrioxide in water op te lossen en zwavelzuur toe te voegen.
Vraag: Is chroomzuur een sterk zuur?
A: Ja, chroomzuur wordt als een sterk zuur beschouwd vanwege het vermogen om protonen te doneren.
Vraag: Hoe maak ik een chroomzuurreinigingsoplossing klaar?
A: Om een chroomzuurreinigingsoplossing te maken, lost u chroomtrioxide op in water en voegt u een kleine hoeveelheid zwavelzuur toe.
Vraag: Welke van de volgende alcoholen zal een positieve chroomzuurtest opleveren?
A: Primaire alcoholen kunnen een positieve chroomzuurtest opleveren, waardoor een kleurverandering ontstaat van oranje naar groen of blauw.
