Chroomtrioxide, ook wel chroomzuur genoemd, is een anorganische verbinding met de formule CrO3. Het is het zuuranhydride van chroomzuur en wordt soms onder dezelfde naam op de markt gebracht.
| IUPAC-naam | Chroom(VI)oxide |
| Moleculaire formule | CrO3 |
| CAS-nummer | 1333-82-0 |
| Synoniemen | Chroomanhydride, chroomoxideanhydride, trioxochroom Chroom (VI) oxide |
| InChi | InChI=1S/Cr.3O |
Eigenschappen van chroomtrioxide
Chroomtrioxide-formule
De formule voor chroomzuuranhydride is CrO3. Het bestaat uit één chroomatoom gebonden aan drie zuurstofatomen.
Chroomtrioxide molaire massa
De molmassa van chroomzuuranhydride wordt berekend door de atoommassa’s van de samenstellende elementen, namelijk chroom (Cr) en zuurstof (O), op te tellen. De molmassa bedraagt ongeveer 99,994 g/mol.
Kookpunt van chroomtrioxide
Chroomzuuranhydride heeft geen duidelijk kookpunt. Bij verhitting valt het uiteen in chroomoxide en zuurstofgas zonder door een vloeibare fase te gaan.
Smeltpunt van chroomtrioxide
Het smeltpunt van chroomzuuranhydride is ongeveer 196°C. Bij deze temperatuur verandert het van vaste naar vloeibare toestand.
Dichtheid van chroomtrioxide g/ml
De dichtheid van chroomzuuranhydride is ongeveer 2,7 g/ml. Deze waarde vertegenwoordigt de massa van de verbinding per volume-eenheid.
Chroomtrioxide Molecuulgewicht
Het molecuulgewicht van chroomzuuranhydride, ook wel molmassa genoemd, is ongeveer 99,994 g/mol. Het is de som van de atoommassa’s van de chroom- en zuurstofatomen in de verbinding.
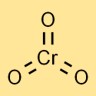
Structuur van chroomtrioxide
Chroomanhydride heeft een moleculaire structuur waarin één chroomatoom centraal gebonden is aan drie zuurstofatomen. Het neemt een tetraëdrische geometrie aan, met het chroomatoom in het midden en de zuurstofatomen op de hoeken.
Oplosbaarheid van chroomtrioxide
Chroomanhydride is zeer oplosbaar in water. Het lost gemakkelijk op en vormt een oplossing van chroomzuur. Door de oplosbaarheid van chroomzuuranhydride in water kan het in verschillende chemische processen en toepassingen worden gebruikt.
| Verschijning | Donkerrode kristallen |
| Soortelijk gewicht | 2,7 g/ml |
| Kleur | Donkerrood |
| Geur | Geurloos |
| Molaire massa | 99,994 g/mol |
| Dikte | 2,7 g/ml |
| Fusie punt | 196°C |
| Kookpunt | Ontbonden |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar |
| Oplosbaarheid | Oplosbaar in verschillende oplosmiddelen zoals ethanol, ether, etc. |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Zuur (in oplossing) |
Veiligheid en gevaren van chroomtrioxide
Chroomanhydride brengt aanzienlijke veiligheidsrisico’s met zich mee en moet met zorg worden behandeld. Het is een zeer bijtende en oxiderende stof die ernstige brandwonden aan de huid, ogen en luchtwegen kan veroorzaken. Inademing of inname van chroomzuuranhydride kan ademhalingsproblemen, maag-darmproblemen en zelfs orgaanschade veroorzaken.
Bij het werken met chroomanhydride moeten geschikte persoonlijke beschermingsmiddelen (PBM’s) worden gedragen, inclusief handschoenen, een veiligheidsbril en een gasmasker. Het moet worden bewaard op een koele, droge plaats, uit de buurt van onverenigbare materialen en ontstekingsbronnen.
Verwijdering van chroomzuuranhydride moet plaatsvinden in overeenstemming met de plaatselijke regelgeving, aangezien het als gevaarlijk afval wordt beschouwd. Het mag niet in het milieu terechtkomen.
| Gevarensymbolen | Bijtend, oxiderend |
| Beveiligingsbeschrijving | Vermijd contact met de huid, ogen en inademing. Gebruik geschikte beschermende uitrusting. |
| VN-identificatienummers | VN 1463 |
| HS-code | 2819.90.90 |
| Gevarenklasse | 5.1 (Oxidatiemiddel) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Chroomtrioxidesynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van chroomzuuranhydride.
Een veelgebruikte methode is de reactie tussen natriumdichromaat en zwavelzuur . In een gecontroleerde omgeving mengt iemand natriumdichromaat (Na2Cr2O7) met geconcentreerd zwavelzuur (H2SO4) . De reactie resulteert in de vorming van een donkerrode oplossing van chroomzuuranhydride (CrO3) en natriumsulfaat (Na2SO4) als bijproduct.
Een andere methode omvat de oxidatie van chroom(III)-verbindingen met behulp van sterke oxidatiemiddelen zoals waterstofperoxide (H2O2) of salpeterzuur (HNO3) . Meng daarbij onder specifieke omstandigheden de chroom(III)-verbinding met het oxidatiemiddel om chroom(III) om te zetten in chroomzuuranhydride.
Bereid chroomzuuranhydride door metallische chroom- of chroom(II)-verbindingen te laten reageren met sterke oxidatiemiddelen zoals kaliumpermanganaat (KMnO4) of kaliumdichromaat (K2Cr2O7). De reactie leidt tot de vorming van chroomzuuranhydride.
Het is belangrijk op te merken dat de synthese van chroomzuuranhydride moet worden uitgevoerd met passende veiligheidsmaatregelen en in overeenstemming met de toepasselijke regelgeving. Ervaren personen moeten het syntheseproces uitvoeren in goed uitgeruste laboratoria om hun veiligheid te garanderen en de gevolgen voor het milieu te minimaliseren.
Gebruik van chroomtrioxide
Chroomzuuranhydride vindt toepassing als oxidatiemiddel in verschillende chemische processen, waaronder de productie van organische verbindingen.
- Fabrikanten gebruiken het om kleurstoffen en pigmenten te produceren, zoals chroomgeel en chroomgroen.
- De galvanische industrie gebruikt het om chroom op metalen oppervlakken aan te brengen, wat corrosiebestendigheid en een aantrekkelijke afwerking oplevert.
- Het wordt gebruikt bij de bereiding van chroomkatalysatoren voor polymerisatiereacties bij de productie van kunststoffen en synthetische materialen.
- Het speelt een rol bij de synthese van farmaceutische producten en organische tussenproducten.
- Houtverduurzamingsbehandelingen gebruiken het als fungicide en insecticide om te beschermen tegen rot en ongedierte.
- Laboratoria gebruiken het als reagens voor verschillende chemische tests en analyses.
- Het gebruik ervan bij de productie van gespecialiseerd glas en keramiek verbetert de kleuren en specifieke eigenschappen.
- De leerindustrie gebruikt het om leer te behandelen en huiden te stabiliseren en te verven.
- Het is een component in de formulering van reinigingsmiddelen en oppervlaktebehandelingen voor metalen oppervlakken.
Het is belangrijk om voorzichtig om te gaan met chroomanhydride vanwege de giftige en corrosieve aard ervan. Naleving van de juiste veiligheidsprotocollen garandeert de bescherming van mens en milieu tijdens het gebruik en de verwijdering ervan.
Vragen:
Vraag: Wat is CrO3?
A: CrO3 is chroomzuuranhydride, een verbinding bestaande uit één chroomatoom gebonden aan drie zuurstofatomen.
Vraag: Is CrO3 een sterk oxidatiemiddel?
A: Ja, CrO3 is een krachtig oxidatiemiddel dat vaak wordt gebruikt in chemische reacties om de oxidatie van verschillende verbindingen te vergemakkelijken.
Vraag: Wat doet CrO3 met alcohol?
A: CrO3 kan alcoholen oxideren en omzetten in de overeenkomstige carbonylverbindingen, zoals aldehyden of ketonen.
Vraag: Welk organisch product zou je verkrijgen uit de reactie van 1-pentanol met CrO3, H2O en H2SO4?
A: De reactie zou het organische product 1-pentanon opleveren, wat een keton is.
Vraag: Wat is de beste reagenskeuze om de volgende transformatie uit te voeren: PCC, HIO4, CrO3, NaOH?
A: De beste reagenskeuze voor deze transformatie is PCC (pyridiniumchloorchromaat).
Vraag: Is CrO3 amfoteer?
A: Nee, CrO3 is niet amfoteer. Het is een zeer zure verbinding, maar kan geen basische eigenschappen vertonen.
Vraag: Hoe vind ik het oxidatiegetal van Cr in CrO3?
A: Het oxidatiegetal van Cr in CrO3 is +6.
Vraag: Wat is de naam van CrO3?
A: De naam van CrO3 is chroomzuuranhydride.
Vraag: Wat doet CrO3 met niet-anonische alcoholen?
A: CrO3 kan niet-anonische alcoholen oxideren en deze omzetten in de overeenkomstige carbonylverbindingen, zoals niet-anonische ketonen.
Vraag: Wat is de lading van het overgangsmetaalkation in CrO3?
A: Het overgangsmetaalkation in CrO3, chroom, heeft een lading van +6.
