Chloorzuur (HClO3) is een sterk, onstabiel zuur dat kan worden geproduceerd door chloordioxide met water te mengen. Het wordt gebruikt in bleek- en desinfectiemiddelen, maar ook bij de productie van explosieven.
| IUPAC-naam | Chloorzuur |
| Moleculaire formule | HClO3 |
| CAS-nummer | 7790-93-4 |
| Synoniemen | Perchloorzuur, chloraat; Chloorzuuroplossing; Chloorzuur (V); Waterstofchloraat; Waterstoftrichloraat |
| InChi | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
De eigenschappen van chloorzuur (HClO3) zijn van bijzonder belang voor scheikundigen en ingenieurs vanwege de vele industriële toepassingen ervan.
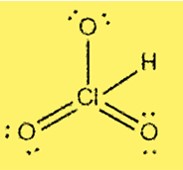
Lewis-structuur HClO3
De Lewis-structuur van HClO3 laat zien dat chloor het centrale atoom is dat gebonden is aan drie zuurstofatomen en één waterstofatoom. Chloor heeft 7 valentie-elektronen en elke zuurstof heeft 6 valentie-elektronen. De structuur omvat drie enkele bindingen en één dubbele binding tussen chloor- en zuurstofatomen.
Chloorzuur (HClO3) formule
De chemische formule voor chloorzuur (HClO3) is HClO3. Het is een anorganisch zuur dat één chlooratoom, één waterstofatoom en drie zuurstofatomen bevat. De formule voor chloorzuur (HClO3) wordt gebruikt om de stoichiometrie en concentratie van oplossingen die het zuur bevatten te berekenen.
Chloorzuur (HClO3) molaire massa
De molaire massa van chloorzuur (HClO3) is 84,46 g/mol. Het is een relatief licht zuur vergeleken met andere anorganische zuren, zoals zwavelzuur, dat een molaire massa heeft van 98,08 g/mol. De molaire massa van chloorzuur (HClO3) is een belangrijke parameter bij het berekenen van de concentratie en stoichiometrie van oplossingen die het zuur bevatten.
Kookpunt van chloorzuur (HClO3)
Chloorzuur (HClO3) heeft een kookpunt van 40,5°C. Het is een zeer vluchtig zuur dat bij hoge temperaturen kan ontleden, waardoor het moeilijk te hanteren en op te slaan is. Het lage kookpunt van chloorzuur (HClO3) is een belangrijke overweging bij het ontwerp van apparatuur en processen waarbij het zuur wordt gebruikt.
Smeltpunt van chloorzuur (HClO3)
Chloorzuur (HClO3) heeft geen goed gedefinieerd smeltpunt. Het kan ontleden voordat het zijn smeltpunt bereikt, waarbij zuurstofgas vrijkomt en een residu van chloraten achterblijft. Het ontbreken van een duidelijk smeltpunt is te wijten aan de instabiliteit van chloorzuur (HClO3).
Dichtheid van chloorzuur (HClO3) g/ml
De dichtheid van chloorzuur (HClO3) is 1,97 g/cm³. Het is een relatief dicht zuur vergeleken met andere anorganische zuren, zoals zoutzuur, dat een dichtheid heeft van 1,18 g/cm³. De hoge dichtheid van chloorzuur (HClO3) is een belangrijke overweging bij het ontwerp van processen waarbij zuur wordt verwerkt en getransporteerd.
Molecuulgewicht van chloorzuur (HClO3)
Het molecuulgewicht van chloorzuur (HClO3) is 84,46 g/mol. Het is de som van de atoomgewichten van de samenstellende elementen: één chlooratoom, één waterstofatoom en drie zuurstofatomen. Het molecuulgewicht van chloorzuur (HClO3) is een belangrijke parameter bij het berekenen van de concentratie en stoichiometrie van oplossingen die het zuur bevatten.
Structuur van chloorzuur (HClO3)
De structuur van chloorzuur bestaat uit een centraal chlooratoom gebonden aan drie zuurstofatomen en één waterstofatoom. Het molecuul heeft een tetraëdrische geometrie, met het chlooratoom in het midden van de tetraëder. De drie zuurstofatomen zijn in een trigonale vlakke opstelling rond het chlooratoom gerangschikt, terwijl het waterstofatoom aan een van de zuurstofatomen is gebonden. De structuur van chloorzuur (HClO3) is belangrijk voor het begrijpen van de chemische eigenschappen en reactiviteit ervan.
| Verschijning | Heldere of geelachtige vloeistof |
| Soortelijk gewicht | 1,97 |
| Kleur | Kleurloos tot geel |
| Geur | Geurloos |
| Molaire massa | 84,46 g/mol |
| Dikte | 1,68 g/cm³ |
| Fusie punt | Ontleedt voordat het smelt |
| Kookpunt | 40,5°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in de meeste organische oplosmiddelen |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| PKa | -0,6 |
| PH | <1 |
Chloorzuur (HClO3) Veiligheid en gevaren
Chloorzuur (HClO3) brengt verschillende veiligheidsrisico’s met zich mee en moet met zorg worden behandeld. Het is een sterk oxidatiemiddel dat heftig kan reageren met veel organische materialen, waaronder brandstoffen, reductiemiddelen en brandbare vloeistoffen. Het kan bij contact ernstige brandwonden aan de huid en ogen veroorzaken en kan bijtend zijn voor metalen oppervlakken. Inademing van de dampen kan irritatie van de luchtwegen en hoesten veroorzaken. Vanwege het reactieve karakter moet het worden opgeslagen en gehanteerd in een goed geventileerde ruimte, uit de buurt van andere chemicaliën. Bij het hanteren van chloorzuur moeten beschermende uitrusting, zoals handschoenen, een veiligheidsbril en een gasmasker, worden gedragen om blootstelling te voorkomen. In geval van huid- of oogcontact dient onmiddellijk medische hulp te worden ingeroepen.
| Gevarensymbolen | Oxidatiemiddel |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen; draag beschermende uitrusting |
| AN-identificaties | VN 3084 |
| HS-code | 2811.19 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Bijtend; kan ernstige brandwonden aan de huid en ogen veroorzaken |
Methoden voor de synthese van chloorzuur (HClO3)
Chloorzuur kan op verschillende manieren worden gesynthetiseerd, waaronder de reactie van chloorgas met natriumhydroxide of natriumchloraat. Een gebruikelijke methode is de reactie van natriumchloraat met zoutzuur.
De chloorzuursynthesereactie omvat de reactie van natriumchloraat (NaClO3) met zoutzuur (HCl) in een tweestapsproces. De eerste stap omvat de omzetting van natriumchloraat in natriumchloriet (NaClO2) en chloordioxide (ClO2) gas in aanwezigheid van een zure katalysator. In de tweede stap reageert chloordioxidegas met overtollig zoutzuur en vormt chloorzuur en chloorgas.
Een andere methode om chloorzuur te synthetiseren omvat de elektrolyse van een oplossing die natriumchloride, salpeterzuur en zwavelzuur bevat. Bij dit proces ontstaat chloorgas dat met water reageert en chloorzuur vormt.
Om chloorzuur te produceren, kan kaliumchloraat in reactie worden gebracht met zwavelzuur en vervolgens wordt het verkregen mengsel gedestilleerd.
De synthese van chloorzuur vereist een zorgvuldige omgang met de reagentia vanwege het risico op gewelddadige reacties en de corrosieve aard van de betrokken zuren. Het is belangrijk om de juiste veiligheidsprotocollen te volgen en materialen te hanteren in een goed geventileerde ruimte met behulp van geschikte beschermende uitrusting.
Gebruik van chloorzuur (HClO3)
Chloorzuur (HClO3) heeft verschillende toepassingen in verschillende industrieën vanwege de sterk oxiderende eigenschappen. Enkele van de toepassingen zijn:
- Productie van andere chemicaliën: Chloorzuur dient als tussenproduct bij de productie van andere chemicaliën, waaronder perchloorzuur, chloraten en perchloraten.
- Bleekmiddel: De pulp- en papierindustrie gebruikt chloorzuur als bleekmiddel.
- Desinfectiemiddel: Chloorzuur fungeert als desinfectiemiddel in de voedingsmiddelen- en drankenindustrie om apparatuur en oppervlakken te desinfecteren.
- Etsmiddel: De halfgeleiderindustrie gebruikt chloorzuur als etsmiddel om ongewenste materiaallagen van halfgeleiderwafels te verwijderen.
- Laboratoriumreagens: Chloorzuur wordt gebruikt als laboratoriumreagens in de analytische chemie en organische synthese.
- Oxidatiemiddel: Chloorzuur wordt gebruikt als oxidatiemiddel bij organisch-chemische reacties.
- Raketstuwstof: Chloorzuur dient als oxidatiemiddel in raketstuwgassen.
- Waterbehandeling: Chloorzuur wordt gebruikt bij de waterbehandeling om de groei van algen en bacteriën onder controle te houden.
Vragen:
Vraag: Is chloorzuur een sterk zuur?
A: Ja, chloorzuur (HClO3) is een sterk zuur.
Vraag: Welke formule vertegenwoordigt chloorzuur?
A: De formule voor chloorzuur is HClO3.
Vraag: Leg uit waarom HCl zoutzuur is en HClO3 chloorzuur?
A: De namen van binaire zuren (verbindingen die slechts twee elementen bevatten) zijn meestal afgeleid van de naam van het anion, met het achtervoegsel -ic voor het meest voorkomende anion en -ous voor het minst voorkomende. In het geval van HCl is het anion chloride (Cl-), dus het zuur wordt zoutzuur genoemd. In het geval van HClO3 is het anion chloraat (ClO3-), dus het zuur wordt chloorzuur genoemd.
Vraag: Wat is de formule voor chloorzuur?
A: De formule voor chloorzuur is HClO3.
Vraag: Is chloorzuur ionisch of moleculair?
A: Chloorzuur is moleculair omdat het bestaat uit covalent gebonden waterstof-, chloor- en zuurstofatomen.
