Chloorsulfonzuur is een sterk zuur met de formule HSO₃Cl. Het is zeer corrosief en wordt gebruikt als reagens bij de organische synthese en als sulfoneringsmiddel voor de vervaardiging van wasmiddelen en kleurstoffen.
| Naam van IUPAC | Chloorsulfonzuur |
| Moleculaire formule | HSO₃Cl |
| CAS-nummer | 7790-94-5 |
| Synoniemen | Zwavelzuurchloorhydrine, chloorzwavelzuur, chloorsulfonzuur |
| InChi | InChI=1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
Eigenschappen van chloorsulfonzuur
Chloorsulfonzuurformule
De formule voor chloorsulfonzuur is HSO₃Cl. Het bestaat uit één waterstofatoom, één zwavelatoom, drie zuurstofatomen en één chlooratoom.
Chloorsulfonzuur molaire massa
De molaire massa van chloorzwavelzuur wordt berekend door de atoommassa’s van de samenstellende atomen op te tellen. De molmassa van HSO₃Cl bedraagt circa 116,5 gram per mol.
Kookpunt van chloorsulfonzuur
Het kookpunt van chloorzwavelzuur is relatief hoog. Het is ongeveer 151 graden Celsius (304 graden Fahrenheit). Bij deze temperatuur verandert chloorzwavelzuur van een vloeibare fase naar een gasfase.
Chloorsulfonzuur Smeltpunt
Chloorzwavelzuur heeft een smeltpunt van ongeveer -82 graden Celsius (-116 graden Fahrenheit). Dit is de temperatuur waarbij de vaste vorm van chloorzwavelzuur in een vloeistof verandert.
Dichtheid van chloorsulfonzuur g/ml
Chloorzwavelzuur heeft een dichtheid van ongeveer 1,75 gram per milliliter (g/ml) bij kamertemperatuur. Dit betekent dat een bepaald volume chloorzwavelzuur relatief zwaar is vergeleken met een gelijk volume water.
Chloorsulfonzuur Molecuulgewicht
Het molecuulgewicht van chloorzwavelzuur wordt berekend door de atoomgewichten van alle atomen in de chemische formule bij elkaar op te tellen. Chloorzwavelzuur heeft een molecuulgewicht van ongeveer 116,5 gram per mol.
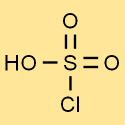
Structuur van chloorsulfonzuur
De structuur van chloorzwavelzuur bestaat uit één zwavelatoom gebonden aan drie zuurstofatomen en één chlooratoom. Het waterstofatoom zit vast aan een van de zuurstofatomen. Deze structuur geeft chloorzwavelzuur zijn unieke eigenschappen en reactiviteit.
Oplosbaarheid van chloorsulfonzuur
Chloorzwavelzuur is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een sterk zure oplossing. De oplosbaarheid van chloorzwavelzuur is te wijten aan zijn polaire aard en de vorming van waterstofbruggen met watermoleculen.
| Verschijning | Kleurloze tot gele vloeistof |
| Soortelijk gewicht | 1,75 (bij 20°C) |
| Kleur | Kleurloos tot geel |
| Geur | Sterke, scherpe geur |
| Molaire massa | 116,5 g/mol |
| Dikte | 1,75 g/ml (bij 20°C) |
| Fusie punt | -82°C (-116°F) |
| Kookpunt | 151°C (304°F) |
| Flitspunt | Niet beschikbaar |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals chloroform, dichloormethaan, nitrobenzeen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | -2,6 |
| pH | Zeer zuur (pH < 1) |
Opmerking: Houd er rekening mee dat de waarden in deze tabel algemene eigenschappen zijn die verband houden met chloorzwavelzuur. De werkelijke waarden kunnen enigszins variëren, afhankelijk van specifieke omstandigheden en zuiverheid van de verbinding.
Veiligheid en gevaren van chloorsulfonzuur
Chloorzwavelzuur brengt aanzienlijke veiligheidsrisico’s met zich mee en moet met uiterste voorzichtigheid worden gehanteerd. Het is zeer bijtend en kan ernstige brandwonden veroorzaken bij contact met de huid, ogen en luchtwegen. Inademing of inslikken kan ernstige gezondheidsrisico’s veroorzaken, waaronder ademhalingsproblemen en schade aan inwendige organen. Het reageert heftig met water, waarbij giftige gassen vrijkomen en warmte ontstaat. Er bestaan brand- en explosierisico’s bij contact met organische materialen. Bij het werken met chloorzwavelzuur moeten adequate persoonlijke beschermingsmiddelen worden gebruikt, zoals handschoenen, een veiligheidsbril en een gasmasker. Goede ventilatie- en inperkingsmaatregelen zijn van cruciaal belang om de blootstelling te minimaliseren en de veiligheid te garanderen bij het hanteren van deze gevaarlijke stof.
| Gevarensymbolen | Bijtend (C), Schadelijk (Xn) |
| Beveiligingsbeschrijving | – Ga uiterst voorzichtig te werk\n- Gebruik de juiste beschermende uitrusting\n- Vermijd contact met de huid, ogen en inademing\n- Opslaan in een goed geventileerde ruimte\n- Niet mengen met water of reactieve stoffen |
| VN-identificatienummers | VN 1751 |
| HS-code | 28121100 |
| Gevarenklasse | Klasse 8 – Bijtende stoffen |
| Verpakkingsgroep | Verpakkingsgroep II |
| Toxiciteit | Zeer giftig; veroorzaakt ernstige brandwonden en ademhalingsschade |
Methoden voor de synthese van chloorsulfonzuur
Er zijn verschillende methoden voor het synthetiseren van chloorzwavelzuur. Een veelgebruikte methode is de reactie tussen zwaveltrioxide (SO₃) en waterstofchloride (HCl) . Bij dit proces wordt de HCl- oplossing doorborreld met SO₃-gas om chloorzwavelzuur te genereren. Zorgvuldige controle van temperatuur en reactieomstandigheden is noodzakelijk vanwege de hoge exothermiciteit van de reactie.
Bij een andere methode ontstaat bij de reactie van chloorgas (Cl₂) met zwavelzuur (H₂SO₄) chloorzwavelzuur. De passage van chloorgas door geconcentreerd zwavelzuur resulteert in de vorming van chloorzwavelzuur. Om de veiligheid te garanderen, moet u passende maatregelen nemen tegen deze exotherme reactie.
Bovendien omvat de bereiding van chloorzwavelzuur de reactie van zwavelzuur met sulfidechloride (SO₂Cl₂). Sulfurylchloride reageert met zwavelzuur en vormt chloorzwavelzuur en waterstofchloridegas.
Opgemerkt moet worden dat de synthese van chloorzwavelzuur moet worden uitgevoerd in een goed uitgerust laboratorium, volgens de juiste veiligheidsprotocollen. De chemicus moet beschermende uitrusting gebruiken, zoals handschoenen, een veiligheidsbril en een capuchon, om hun veiligheid te garanderen.
Met deze synthesemethoden kunnen chemici chloorzwavelzuur produceren, een veelzijdige verbinding die wordt gebruikt in een verscheidenheid aan industriële toepassingen, waaronder organische synthese, sulfoneringsreacties en de productie van kleurstoffen en detergentia.
Gebruik van chloorsulfonzuur
Chloorzwavelzuur vindt brede toepassingen in verschillende industrieën vanwege zijn veelzijdige eigenschappen. Hier zijn enkele toepassingen:
- Chloorzwavelzuur neemt actief deel aan verschillende organische synthesereacties, waaronder veresteringen, sulfoneringen en halogeneringen, en dient als een krachtig reagens. Het introduceert op efficiënte wijze functionele groepen en wijzigt moleculaire structuren.
- Bij de vervaardiging van kleurstoffen speelt chloorzwavelzuur een cruciale rol omdat het aromatische verbindingen actief sulfoneert, waardoor sulfonzuurgroepen kunnen ontstaan. Deze groepen verbeteren de oplosbaarheid van kleurstoffen en verbeteren de kleureigenschappen.
- Bij de productie van wasmiddelen fungeert chloorzwavelzuur actief als sulfoneringsmiddel tijdens de synthese van wasmiddelen. Het draagt actief bij aan de vorming van oppervlakteactieve stoffen, waardoor hun reinigende en schuimende eigenschappen worden verbeterd.
- De farmaceutische industrie maakt op grote schaal gebruik van chloorzwavelzuur als een actieve component bij onderzoek en productie. Het introduceert actief sulfonamidegroepen in medicijnmoleculen, wat een aanzienlijke impact heeft op hun farmacologische eigenschappen.
- Bij polymerisatiereacties wordt actief chloorzwavelzuur gebruikt als katalysator of initiator voor de synthese van speciale polymeren. Deze polymeren vinden actief toepassingen in verschillende industrieën, zoals coatings, lijmen en elektrische isolatie.
- Het dient als een belangrijk tussenproduct bij de productie van verschillende chemicaliën, waaronder sulfonzuren, zwavelzuuresters en chloorsulfonaten. Deze verbindingen vinden toepassingen in verschillende industrieën, zoals de farmaceutische industrie, de landbouwchemicaliën en de productie van polymeren.
- In het laboratorium gebruiken onderzoekers chloorzwavelzuur actief als reagens voor verschillende chemische reacties, zoals verestering, acylering en dehydratatiereacties.
Het is belangrijk om voorzichtig om te gaan met chloorzwavelzuur vanwege de corrosieve aard ervan en de potentiële gezondheidsrisico’s.
Vragen:
Vraag: Hoe maak ik acetamidobenzeensulfonylchloride aan uit acetanilide en chloorsulfonzuur?
A: Acetamidobenzeensulfonylchloride wordt gevormd door acetanilide te behandelen met chloorzwavelzuur, resulterend in de vervanging van de aminogroep door de sulfonylchloridegroep.
Vraag: Hoe gebruik ik chloorsulfonzuur?
A: Chloorzwavelzuur wordt gebruikt als reagens in verschillende chemische reacties, zoals sulfonering, verestering en acylering, om functionele groepen te introduceren of moleculaire structuren te wijzigen.
Vraag: Is chloorsulfonzuur een goede vertrekkende groep?
A: Ja, chloorzwavelzuur is een goede vertrekkende groep vanwege de stabiliteit van de sulfonzuurgroep en zijn vermogen om substitutiereacties te ondergaan.
Vraag: Hoe chloorsulfonzuur verwijderen?
A: Chloorzwavelzuur moet worden geneutraliseerd met een base, zoals natriumcarbonaat, vervolgens worden verdund met water en zorgvuldig worden verwijderd in overeenstemming met de plaatselijke regelgeving.
Vraag: Wat gebeurt er als chloorsulfonzuur in contact komt met water?
A: Wanneer chloorzwavelzuur in contact komt met water, reageert het krachtig, waarbij warmte en giftige gassen vrijkomen, zoals zwaveldioxide en waterstofchloride.
Vraag: Kan natriumlaurylsulfaat worden bereid door chloorsulfonzuur te vervangen door een ander reagens?
A: Ja, natriumlaurylsulfaat kan worden gesynthetiseerd door chloorzwavelzuur te vervangen door zwavelzuur in de reactie met laurylalcohol, gevolgd door neutralisatie met natriumhydroxide.
Vraag: Wat is de dichtheid van chloorsulfonzuur?
A: De dichtheid van chloorzwavelzuur is ongeveer 1,75 g/ml bij kamertemperatuur.
Vraag: Hoeveel mol chloorsulfonzuur zijn er nodig om één mol acetamidobenzeensulfonylchloride te produceren?
A: Eén mol acetamidobenzeensulfonylchloride kan worden verkregen door één mol acetanilide te laten reageren met één mol chloorzwavelzuur.
Vraag: Kan chloorsulfonzuur worden opgeslagen met oxidatiemiddelen?
A: Nee, chloorzwavelzuur moet gescheiden van oxidatiemiddelen worden bewaard, omdat het heftig kan reageren of het risico op brand kan vergroten wanneer het in contact komt met oxiderende stoffen.
