Chloor (Cl2) is een zeer reactief groengeel gas. Het wordt gebruikt bij de waterbehandeling, als desinfectiemiddel en bij de productie van verschillende chemicaliën, zoals PVC en oplosmiddelen.
| IUPAC-naam | Dichloor |
| Moleculaire formule | Kl2 |
| CAS-nummer | 7782-50-5 |
| Synoniemen | Moleculair chloor, Chloor, Cloro, Chloor, Chloor, Cloreto de cloro |
| InChi | InChI=1S/Cl2/c1-2 |
Cl2 Molaire massa
De molaire massa van Cl2, of chloor, is de som van de atoommassa’s van twee chlooratomen, oftewel 70,906 g/mol. Het is belangrijk om de molaire massa van Cl2 te kennen bij het berekenen van de hoeveelheid stof die nodig is voor een chemische reactie of bij het omrekenen tussen verschillende meeteenheden.
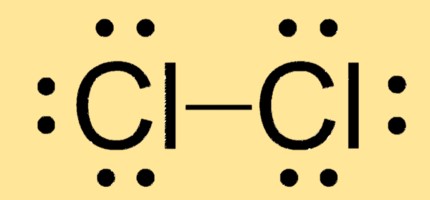
Lewis-structuur Cl2
Cl2 heeft een lineaire moleculaire geometrie met twee chlooratomen verbonden door een enkele covalente binding. De Lewis-structuur bestaat uit twee Cl-atomen, elk met drie alleenstaande paren en één gedeeld elektronenpaar.
Kookpunt Cl2
Het kookpunt van Cl2 is -34,04°C (-29,27°F) bij standaarddruk. Dit is een relatief laag kookpunt, waarbij bij kamertemperatuur en druk gasvormig Cl2 ontstaat. Het is belangrijk om voorzichtig te zijn bij het hanteren van Cl2, omdat het bij lage temperaturen en druk gemakkelijk in een vloeistof of vaste stof kan veranderen.
Cl2 Smeltpunt
Het smeltpunt van Cl2 is -101,5°C (-150,7°F) bij standaarddruk. Dit is een relatief laag smeltpunt, waardoor bij kamertemperatuur en druk gasvormig Cl2 ontstaat. Het is belangrijk om voorzichtig te zijn bij het hanteren van Cl2, omdat het bij lage temperaturen en druk gemakkelijk in een vloeistof of vaste stof kan veranderen.
Cl2 Dichtheid g/ml
De dichtheid van Cl2 is 0,003214 g/ml bij standaardtemperatuur en druk (STP). Dit betekent dat Cl2 veel minder dicht is dan lucht en in de atmosfeer zal opstijgen. Cl2 kan worden opgeslagen in cilinders onder druk of in tanks die gassen bevatten die zwaarder zijn dan lucht, zoals stikstof.
Molecuulgewicht van chloor
Het molecuulgewicht van Cl2 is 70,906 g/mol. Dit is de massa van één mol Cl2, die het aantal moleculen van Avogadro bevat (6,022 x 10^23). Het molecuulgewicht van Cl2 is belangrijk voor stoichiometrische berekeningen in de scheikunde.
Structuur van chloor
De structuur van Cl2 is lineair, waarbij twee chlooratomen met elkaar verbonden zijn door een covalente binding. De bindingslengte tussen de twee chlooratomen is 1,99 Ångstrom en de bindingsenergie is 242 kJ/mol. De elektronische configuratie van Cl2 is [Ne]3s23p5, waarbij elk chlooratoom één elektron bijdraagt aan het bindingspaar.
Chloor formule
De formule voor Cl2 is eenvoudigweg twee Cl-atomen die aan elkaar zijn gebonden. Dit wordt weergegeven door Cl-Cl of Cl2. De formule is belangrijk voor het identificeren van de samenstelling van een verbinding of molecuul en voor stoichiometrische berekeningen in de chemie.
| Verschijning | Groenachtig geel gas |
| Soortelijk gewicht | 1,56 (vloeistof) |
| Kleur | groenachtig geel |
| Geur | Scherpe en verstikkende geur |
| Molaire massa | 70,906 g/mol |
| Dikte | 0,003214 g/ml bij STP |
| Fusie punt | -101,5°C (-150,7°F) |
| Kookpunt | -34,04°C (-29,27°F) |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 0,92 g/100 ml bij 20°C |
| Oplosbaarheid | Oplosbaar in water, ethanol, ether, benzeen en vele organische oplosmiddelen |
| Dampdruk | 102,44 kPa bij 20°C |
| Dampdichtheid | 2,49 (lucht = 1) |
| pKa | – |
| pH | – |
Cl2 Veiligheid en gevaren
Chloor is een zeer reactief gas dat ernstige veiligheids- en gezondheidsrisico’s kan opleveren als het niet op de juiste manier wordt behandeld. Het kan ernstige irritatie van de luchtwegen en schade aan de ogen, huid en slijmvliezen veroorzaken. Inademing van hoge concentraties chloor kan longoedeem veroorzaken, wat levensbedreigend kan zijn. Chloor is ook zeer corrosief en kan metalen, kunststoffen en andere materialen beschadigen. Om een veilige omgang met chloor te garanderen, moeten geschikte persoonlijke beschermingsmiddelen worden gedragen, zoals een veiligheidsbril, handschoenen en een gasmasker. Chloor mag alleen worden gebruikt in goed geventileerde ruimtes en alle containers moeten correct worden geëtiketteerd en op een veilige locatie worden bewaard.
| Gevarensymbolen | Schedel en gekruiste knekels |
| Beveiligingsbeschrijving | Zeer giftig en corrosief gas; veroorzaakt ernstige irritatie van de luchtwegen en de huid; kan dodelijk zijn bij inademing in hoge concentraties |
| VN-identificatienummers | UN1017 |
| HS-code | 2801.1 |
| Gevarenklasse | 2.3 |
| Verpakkingsgroep | I |
| Toxiciteit | Zeer giftig; inademing van hoge concentraties kan longoedeem veroorzaken en fataal zijn |
Chloorsynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van chloorgas, waaronder pekelelektrolyse, HCl-oxidatie en thermische ontleding van metaalchloriden.
De meest gebruikelijke methode is pekelelektrolyse, waarbij een elektrische stroom door een oplossing van natriumchloride (NaCl) en water (H2O) wordt geleid. Bij dit proces ontstaat chloorgas aan de anode en waterstofgas aan de kathode.
Een andere methode om chloor te produceren is de oxidatie van HCl met een oxidatiemiddel, zoals KMnO4 of MnO2. Bij deze reactie ontstaan chloorgas en water als bijproducten.
Thermische ontleding van metaalchloriden, zoals MgCl2 of FeCl3, is een andere methode om chloorgas te genereren. Bij dit proces wordt het metaalchloride tot een hoge temperatuur verwarmd, waardoor het uiteenvalt en chloorgas vrijkomt.
Over het geheel genomen is de gebruikte synthesemethode voor chloor afhankelijk van de specifieke toepassing en de gewenste zuiverheid van het gas. Ongeacht de gebruikte methode is het belangrijk om voorzichtig om te gaan met chloor vanwege de zeer reactieve en giftige aard ervan.
Gebruik van chloor
Chloorgas heeft een breed scala aan toepassingen in verschillende industrieën. Een van de belangrijkste toepassingen van chloor is de productie van polyvinylchloride (PVC), een veelgebruikt kunststofmateriaal. Chloor wordt ook gebruikt bij de productie van andere chloorverbindingen, zoals chloroform en tetrachloorkoolstof, die worden gebruikt als oplosmiddelen en bij de vervaardiging van koelmiddelen.
In de waterzuiveringsindustrie wordt chloor vaak gebruikt als desinfectiemiddel voor de behandeling van drinkwater en afvalwater. Chloorgas is effectief in het doden van bacteriën en virussen, en het kan ook organische verbindingen en andere verontreinigingen uit water oxideren en verwijderen.
In de pulp- en papierindustrie wordt chloorgas gebruikt als bleekmiddel om papierproducten witter te maken. Het wordt ook gebruikt bij de productie van textiel, zoals nylon en polyester, maar ook bij de vervaardiging van kleurstoffen en pigmenten.
Chloorgas heeft ook andere toepassingen, met name bij de productie van bepaalde farmaceutische producten en in de metallurgische industrie voor het strippen en reinigen van metalen oppervlakken. Vanwege de gevaarlijke aard ervan moet er echter met zorg worden omgegaan met chloor en moeten er passende veiligheidsmaatregelen worden genomen tijdens de opslag, het transport en het gebruik ervan.
Vragen:
Vraag: Is Cl2 polair of niet-polair?
A: Cl2 is een niet-polair molecuul.
Vraag: Is chloor een metaal?
A: Nee, chloor is geen metaal. Het is een halogeen en behoort tot de groep van niet-metalen elementen.
Vraag: Welk zacht metaal wordt gecombineerd met chloor om tafelzout te maken?
A: Natrium (Na) is het zachte metaal dat samen met chloor (Cl) keukenzout (NaCl) produceert.
Vraag: Hoe water chloreren?
A: Chlorering van water wordt doorgaans gedaan door een afgemeten hoeveelheid chloorgas, natriumhypochloriet of calciumhypochloriet aan de watertoevoer toe te voegen. De toegevoegde hoeveelheid chloor is afhankelijk van de waterkwaliteit en de gewenste mate van desinfectie. Chloor reageert met bacteriën en andere micro-organismen in het water, waardoor deze effectief worden gedood en het water veilig wordt gemaakt om te drinken.
Vraag: Welke van de volgende producten wordt behandeld met chloor om bleekpoeder te verkrijgen?
A: Calciumoxide (CaO) wordt behandeld met chloor (Cl2) om bleekpoeder (CaOCl2) te verkrijgen.
