Methanol (CH3OH) is een kleurloze, brandbare vloeistof met een zoete geur. Het wordt gebruikt als oplosmiddel, brandstof en antivries. Het kan giftig zijn als het wordt ingeslikt en blindheid of de dood veroorzaken.
| IUPAC-naam | Methanol |
| Moleculaire formule | CH4O |
| CAS-nummer | 67-56-1 |
| Synoniemen | Methylalcohol, houtalcohol, hydroxymethaan, carbinol, houtnafta, koloniale geest |
| InChi | InChI=1S/CH4O/c1-2/h2H,1H3 |
Opmerking: InChI is een lange keten die de unieke structuur van een molecuul vertegenwoordigt. Het wordt mogelijk niet correct weergegeven op sommige apparaten.
Eigenschappen van methanol
Methanol Molaire massa
De molaire massa van methanol is 32,04 g/mol. Het wordt berekend door de atoomgewichten van koolstof-, waterstof- en zuurstofatomen in één enkel methanolmolecuul op te tellen. Deze waarde is nuttig voor het bepalen van de hoeveelheid methanol die nodig is om een bepaalde concentratie van een oplossing te bereiden of voor het bepalen van de stoichiometrie van een chemische reactie.
Kookpunt van methanol
Methanol heeft een kookpunt van 64,7°C (148,46°F). Dit relatief lage kookpunt maakt methanol bruikbaar als oplosmiddel in diverse industriële toepassingen, waaronder de productie van formaldehyde, azijnzuur en methylmethacrylaat. Het lage kookpunt van methanol maakt het echter ook vluchtig en ontvlambaar, wat veiligheidsrisico’s kan opleveren tijdens opslag, hantering en transport.
Smeltpunt van methanol
CH3OH heeft een smeltpunt van -97,6°C (-143,68°F). Dit betekent dat CH3OH bij kamertemperatuur een vloeistof is, maar gemakkelijk in vaste vorm kan worden ingevroren door het tot onder het smeltpunt af te koelen. Het lage smeltpunt van CH3OH is ook nuttig in sommige laboratoriumtoepassingen, zoals de bereiding van cryogene oplosmiddelen voor nucleaire magnetische resonantiespectroscopie.
Dichtheid van methanol g/ml
De dichtheid van CH3OH is 0,792 g/ml bij 20°C (68°F). Dit betekent dat CH3OH een lagere dichtheid heeft dan water en erop kan drijven. De dichtheid van CH3OH kan ook worden gebruikt om het volume CH3OH te berekenen dat nodig is om een bepaalde massa of concentratie van de oplossing te verkrijgen.
Methanol Molecuulgewicht
Het molecuulgewicht van CH3OH is 32,04 g/mol. Deze waarde wordt berekend door de atoomgewichten van koolstof-, waterstof- en zuurstofatomen in één enkel CH3OH-molecuul op te tellen. Het molecuulgewicht van CH3OH is nuttig bij het bepalen van de fysische eigenschappen ervan, zoals kookpunt, smeltpunt en dichtheid.
Structuur van methanol
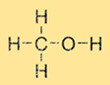
Methanol heeft een eenvoudige structuur bestaande uit een methylgroep (CH3) en een hydroxylgroep (-OH) gebonden aan een enkel koolstofatoom. De molecuulformule voor methanol is CH3OH. Methanol is een polair molecuul vanwege de aanwezigheid van de hydroxylgroep, waardoor het oplosbaar is in polaire oplosmiddelen zoals water en ethanol.
Methanol-formule
De chemische formule voor methanol is CH3OH. Dit betekent dat elk methanolmolecuul één koolstofatoom, vier waterstofatomen en één zuurstofatoom bevat. De methanolformule kan worden gebruikt om het molecuulgewicht en andere fysische eigenschappen van methanol te bepalen. De chemische formule van methanol is ook nuttig voor het schrijven van chemische vergelijkingen en het balanceren van chemische reacties waarbij methanol betrokken is.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,792 g/ml bij 20°C |
| Kleur | Kleurloos |
| Geur | Zoet, kruidig |
| Molaire massa | 32,04 g/mol |
| Dikte | 0,792 g/ml bij 20°C |
| Fusie punt | -97,6°C |
| Kookpunt | 64,7°C |
| Flitspunt | 11,1°C |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Mengbaar met ethanol, ether, aceton en vele organische oplosmiddelen |
| Dampdruk | 13,02 kPa bij 20°C |
| Dampdichtheid | 1,11 (lucht = 1) |
| pKa | 15.5 |
| pH | 7 (neutraal) |
Opmerking: de waarden in deze tabel zijn bij benadering en kunnen variëren afhankelijk van specifieke omstandigheden en methanolbronnen.
Veiligheid en gevaren van methanol
CH3OH brengt verschillende veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden behandeld. Het is een brandbare vloeistof en kan ontbranden bij blootstelling aan hitte, vonken of vlammen. CH3OH-dampen kunnen ook met lucht explosieve mengsels vormen. Het inademen van CH3OH-dampen kan duizeligheid, hoofdpijn, misselijkheid en andere gezondheidsproblemen veroorzaken. CH3OH is ook giftig en kan door de huid worden opgenomen of worden ingeslikt, wat ernstige gezondheidscomplicaties kan veroorzaken, waaronder blindheid, coma en de dood. Het is belangrijk om beschermende kleding te dragen en CH3OH te hanteren in een goed geventileerde ruimte met de juiste veiligheidsuitrusting, zoals een veiligheidsbril, handschoenen en een gasmasker. Gemorst materiaal moet onmiddellijk worden opgeruimd en op de juiste wijze worden afgevoerd.
| Gevarensymbolen | Schedel en gekruiste knekels, brandbaar |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Gebruik explosieveilige elektrische/ventilatie/verlichtingsapparatuur. Houd de container goed gesloten. Grond-/borgcontainer en ontvangstapparatuur. Gebruik uitsluitend vonkvrij gereedschap. Neem voorzorgsmaatregelen tegen statische ontladingen. Vermijd inademen van dampen. Na gebruik goed wassen. Niet eten, drinken of roken tijdens het gebruik van dit product. |
| AN-identificaties | UN1230 |
| HS-code | 29051100 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Methanol is giftig en kan blindheid, coma en de dood veroorzaken als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Het kan bij contact ook irritatie, roodheid en brandwonden veroorzaken. Blootstelling aan methanoldampen kan hoofdpijn, duizeligheid, misselijkheid en andere gezondheidsproblemen veroorzaken. Er moet met uiterste voorzichtigheid en met de juiste beschermende uitrusting worden omgegaan met methanol. |
Opmerking: de waarden in deze tabel zijn bij benadering en kunnen variëren afhankelijk van specifieke omstandigheden en methanolbronnen. Het is belangrijk om het veiligheidsinformatieblad en de geldende regelgeving te raadplegen bij de omgang met methanol.
Methoden voor methanolsynthese
Directe oxidatie van methaan, gedeeltelijke oxidatie van aardgas, vergassing van steenkool en synthese uit kooldioxide en waterstof synthetiseren allemaal methanol.
Een van de meest gebruikelijke methoden voor het synthetiseren van methanol is het katalytisch omzetten van het syngas, dat een mengsel is van koolmonoxide, kooldioxide en waterstof. Bij dit proces wordt gebruik gemaakt van een katalysator, meestal op koperbasis, om de reactie te vergemakkelijken. Het syngas wordt bij hoge temperaturen en drukken in een reactor gebracht die de katalysator bevat, wat resulteert in de productie van methanol.
Een andere methode voor het synthetiseren van methanol omvat het direct oxideren van methaan, waarbij gebruik wordt gemaakt van hoge temperaturen en drukken in aanwezigheid van een katalysator zoals platina of palladium. Deze methode is moeilijker en duurder dan de syngasmethode, maar is efficiënter en kan hogere opbrengsten opleveren.
Gedeeltelijke oxidatie van aardgas is een andere methode voor de synthese van methanol, waarbij zuurstof of lucht wordt gebruikt om aardgas gedeeltelijk te oxideren, waarbij een mengsel van koolmonoxide en waterstof ontstaat. Het mengsel wordt vervolgens in een reactor gebracht die een katalysator bevat, wat resulteert in de productie van methanol.
Steenkoolvergassing is een andere methode voor de synthese van methanol, waarbij steenkool wordt omgezet in syngas, gevolgd door hetzelfde katalytische omzettingsproces als hierboven beschreven.
Door het afvangen en benutten van koolstof wordt de kooldioxide-uitstoot van industriële processen omgezet in methanol, waarbij waterstof als reductiemiddel wordt gebruikt.
Gebruik van methanol
Methanol heeft een breed scala aan toepassingen in verschillende industrieën, waaronder:
- Brandstof: Voertuigen, generatoren en andere industriële apparatuur kunnen methanol als brandstof gebruiken.
- Oplosmiddel: Methanol is een uitstekend oplosmiddel voor veel stoffen, waaronder harsen, kleurstoffen en oliën. Fabrikanten gebruiken methanol om verven, vernissen en andere coatings te produceren.
- Chemisch tussenproduct: gebruikt als grondstof voor de productie van formaldehyde, azijnzuur en andere chemicaliën.
- Antivries: Gebruikt als antivriesmiddel in koelsystemen voor auto’s.
- Ontdooimiddel: Gebruikt als ontdooimiddel voor vliegtuigvleugels en start- en landingsbanen van luchthavens.
- Reiniger: Gebruikt als reinigingsmiddel in diverse industriële processen.
- Farmaceutische producten: Gebruikt als oplosmiddel bij de productie van veel farmaceutische producten.
- Alternatieve energie: onderzocht als alternatieve brandstof voor brandstofcellen en als potentieel medium voor energieopslag.
- Methanol naar olefinen (MTO): Olefinen zoals ethyleen en propyleen komen voort uit de omzetting van methanol.
- Methanol naar benzine (MTG): Een proces genaamd MTG zet methanol om in benzine.
Vragen:
Vraag: Wat is methanol?
A: Methanol, ook bekend als houtalcohol, is een kleurloze, brandbare vloeistof met een zoete geur. Het is de eenvoudigste alcohol en de chemische formule is CH3OH.
Vraag: Is methanol polair of niet-polair?
A: Methanol is een polair molecuul. Het heeft een positieve gedeeltelijke lading op de waterstofatomen en een negatieve gedeeltelijke lading op het zuurstofatoom, wat resulteert in een dipoolmoment.
Vraag: Waar wordt methanol voor gebruikt?
A: Methanol heeft een breed scala aan toepassingen in verschillende industrieën, waaronder als brandstof, oplosmiddel, chemisch tussenproduct, antivriesmiddel, ontijzingsmiddel, reiniger, farmaceutisch oplosmiddel en potentiële energieopslagmedia. Het wordt ook gebruikt bij de productie van formaldehyde, azijnzuur en andere chemicaliën. Daarnaast wordt methanol omgezet in olefinen zoals ethyleen en propyleen, die worden gebruikt als grondstof voor de productie van kunststoffen.
