Tetrabroomethaan is een chemische verbinding met de formule CBr4. Het is een kleurloze kristallijne vaste stof met een zoete geur, gebruikt als oplosmiddel en vlamvertrager. Het is giftig en kan schadelijk zijn voor mens en milieu.
| IUPAC-naam | Tetrabroommethaan |
| Moleculaire formule | CBr4 |
| CAS-nummer | 558-13-4 |
| Synoniemen | Koolstoftetrabromide, tetrabroomform, perbroommethaan, tetrabroommethaan |
| InChi | InChI=1S/CBr4/c2-1(3,4)5 |
Eigenschappen van tetrabroommethaan
Molaire massa CBr4
Tetrabroomethaan heeft een molaire massa van ongeveer 331,63 g/mol. Het is een relatief zware verbinding vergeleken met andere organische moleculen. De molaire massa van tetrabroomethaan wordt bepaald door de atoommassa’s van alle atomen in het molecuul op te tellen. In dit geval bestaat het uit één koolstofatoom en vier broomatomen.
Kookpunt van CBr4
Tetrabroomethaan heeft een kookpunt van 189°C (372°F). Dit is de temperatuur waarbij de dampspanning van vloeibaar tetrabroomethaan gelijk is aan de atmosferische druk. Bij deze temperatuur begint het vloeibare tetrabroommethaan te koken en te verdampen tot een gas.
Smeltpunt van CBr4
CBr4 heeft een smeltpunt van 90,5 °C (194,9 °F). Dit is de temperatuur waarbij vast CBr4 overgaat naar de vloeibare toestand. CBr4 heeft een relatief hoog smeltpunt voor een organisch molecuul, waarschijnlijk vanwege het hoge molecuulgewicht en de intermoleculaire krachten.
Dichtheid CBr4 g/ml
De dichtheid van tetrabroomethaan is 3,42 g/ml bij kamertemperatuur. Dit betekent dat een bepaald volume tetrabroommethaan 3,42 keer meer weegt dan hetzelfde volume water. De hoge dichtheid van tetrabroomethaan is te danken aan het hoge molecuulgewicht en de strakke opstelling van de atomen.
Molecuulgewicht CBr4
Het molecuulgewicht van tetrabroomethaan is 331,63 g/mol. Het is het gecombineerde gewicht van alle atomen in het molecuul. Het molecuulgewicht van tetrabroomethaan is belangrijk voor het berekenen van de fysische eigenschappen ervan en voor het begrijpen van het gedrag ervan in chemische reacties.
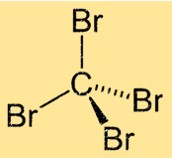
CBr4-structuur
Tetrabroommethaan heeft een tetraëdrische moleculaire geometrie, met het koolstofatoom in het midden en de vier broomatomen eraan vastgemaakt. Het molecuul heeft een symmetrische structuur met vier identieke Br-C-bindingen die onder gelijke hoeken rond het centrale koolstofatoom zijn gerangschikt. Deze structuur geeft tetrabroomethaan zijn unieke fysische en chemische eigenschappen.
Tetrabroommethaan-formule
De formule voor tetrabroomethaan is CBr4. Dit betekent dat het bestaat uit één koolstofatoom en vier broomatomen. De formule van tetrabroomethaan is belangrijk voor het begrijpen van de chemische structuur en het voorspellen van de reactiviteit met andere moleculen.
| Verschijning | Kleurloze tot lichtgele kristallijne vaste stof |
| Soortelijk gewicht | 3,42 g/ml |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Zacht |
| Molaire massa | 331,63 g/mol |
| Dikte | 3,42 g/ml |
| Fusie punt | 90,5°C (194,9°F) |
| Kookpunt | 189°C (372°F) |
| Flitspunt | Niet vlambaar |
| oplosbaarheid in water | 0,0032 g/100 ml bij 20°C |
| Oplosbaarheid | Onoplosbaar in water, oplosbaar in benzeen, chloroform en koolstofdisulfide |
| Dampdruk | 0,006 mmHg bij 25°C |
| Dampdichtheid | 14,2 (tegen lucht) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van tetrabroommethaan
Tetrabroomethaan kan verschillende gevaren met zich meebrengen als het niet op de juiste manier wordt behandeld. Het is schadelijk bij inslikken, inademen of bij contact met de huid. Blootstelling aan tetrabroomethaan kan irritatie, hoofdpijn, duizeligheid en misselijkheid veroorzaken. Langdurige blootstelling kan leiden tot lever- en nierschade. Het is ook een potentieel gevaar voor het milieu en mag niet in het milieu terechtkomen. Bij het hanteren van tetrabroommethaan moeten passende voorzorgsmaatregelen worden genomen, waaronder het gebruik van beschermende kleding en uitrusting. In geval van accidentele blootstelling moet onmiddellijk medische hulp worden ingeroepen. Tetrabroommethaan moet worden opgeslagen en verwerkt in een goed geventileerde ruimte en in overeenstemming met de toepasselijke veiligheidsprotocollen.
| Gevarensymbolen | T (giftig) |
| Beveiligingsbeschrijving | Niet inslikken, inademen en niet in contact komen met de huid. Draag beschermende kleding en uitrusting. Raadpleeg een arts in geval van accidentele blootstelling. |
| VN-identificatienummers | VN 2515 |
| HS-code | 2903.90.9000 |
| Gevarenklasse | 6.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken, inademen of opname via de huid. Kan irritatie, hoofdpijn, duizeligheid en misselijkheid veroorzaken. Langdurige blootstelling kan lever- en nierschade veroorzaken. |
Methoden voor de synthese van tetrabroommethaan
Om tetrabromethaan te synthetiseren, kunnen onderzoekers methaan broomen, koolstoftetrabromide laten reageren met waterstofgas of broom laten reageren met natriumformiaat.
Methaanbromering omvat de reactie van methaan met broom in aanwezigheid van een katalysator, zoals ijzer- of aluminiumbromide. U kunt het mengsel van broommethanen dat ontstaat uit het proces om tetrabroommethaan te verkrijgen, scheiden en zuiveren.
Om tetrabromethaan te synthetiseren, kan koolstoftetrabromide in reactie worden gebracht met waterstofgas in aanwezigheid van een katalysator zoals nikkel. Deze reactie produceert een mengsel van broommethanen, die onderzoekers kunnen scheiden en zuiveren om tetrabroommethaan te verkrijgen.
Een andere methode voor het synthetiseren van tetrabroomethaan omvat de reactie van broom met natriumformiaat in aanwezigheid van zwavelzuur. Scheiding en zuivering van het resulterende product van tetrabroomethaan en natriumsulfaat zal tetrabroomethaan opleveren.
Gebruik van tetrabroomethaan
Tetrabroomethaan heeft vanwege zijn unieke eigenschappen verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Vlamvertrager: Gebruikt als vlamvertrager in kunststoffen, textiel en andere materialen. Het werkt door broom vrij te geven bij blootstelling aan hitte, wat het verbrandingsproces remt.
- Chemisch tussenproduct: Gebruikt als chemisch tussenproduct bij de productie van andere chemicaliën, zoals farmaceutische producten en landbouwchemicaliën.
- Oplosmiddel: Gebruikt als oplosmiddel voor verschillende organische verbindingen, vooral bij de productie van pesticiden.
- Testmiddel: gebruikt als testmiddel voor de detectie van onzuiverheden in andere chemicaliën.
- Raffinagemiddel: gebruikt als raffinagemiddel bij de productie van aluminium en andere metalen.
- Diergeneeskunde: Gebruikt in de diergeneeskunde als anthelminticum of ontwormingsmiddel voor de behandeling van parasitaire infecties bij dieren.
Vragen:
Vraag: Is CBR4 polair of niet-polair?
A: Tetrabroommethaan (cbr4) is een niet-polair molecuul vanwege de symmetrische tetraëdrische structuur en het ontbreken van polaire bindingen.
Vraag: Welke van de volgende verbindingen zijn polair: cbr4, xef2, scl4, brf3, ch3oh?
A: Van de gegeven verbindingen zijn alleen CH3OH (methanol) en BRF3 (broomtrifluoride) polaire moleculen vanwege hun asymmetrische moleculaire structuren en de aanwezigheid van polaire bindingen.
Vraag: Is cbr4 wateroplosbaar?
A: Tetrabroomethaan is niet oplosbaar in water vanwege zijn niet-polaire aard, onverenigbaar met de polaire aard van water.
Vraag: Wat is de naam van de verbinding met formule cbr4? A: De verbinding met formule cbr4 wordt tetrabroomethaan of koolstoftetrabromide genoemd.
