Calciumperchloraat (Ca(ClO4)2) is een chemische verbinding die vele toepassingen kent, onder meer in vuurwerk en raketbrandstof. Het is zeer oplosbaar in water en kan ook als droogmiddel worden gebruikt.
| IUPAC-naam | Calciumperchloraat |
| Moleculaire formule | Ca(ClO4)2 |
| CAS-nummer | 13477-36-6 |
| Synoniemen | Calciofos, calciumzout van perchloorzuur, calciumdiperchloraat, calcium (II) perchloraat, UN1459 |
| InChi | InChI=1S/Ca.2ClHO4/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Eigenschappen van calciumperchloraat
Calciumperchloraatformule
De formule voor calciumperchloraat is Ca(ClO4)2. Het bestaat uit één Ca2+-ion en twee ClO4–ionen. Het calciumion heeft een positieve lading van 2+ en elk ClO4-ion heeft een negatieve lading van 1-. Deze formule wordt gebruikt om de chemische structuur van calciumperchloraat weer te geven.
Calciumperchloraat Molaire massa
De molmassa van Ca(ClO4)2 bedraagt 238,98 g/mol. Deze waarde vertegenwoordigt de massa van één mol Ca(ClO4)2, die het aantal moleculen van Avogadro bevat. De molaire massa is belangrijk bij het bepalen van de hoeveelheid Ca(ClO4)2 die nodig is voor een bepaalde reactie.
Kookpunt van calciumperchloraat
Ca(ClO4)2 heeft geen kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt het uiteen in calciumchloride, zuurstofgas en chloorgas. Deze ontledingsreactie is sterk exotherm, waarbij een aanzienlijke hoeveelheid warmte vrijkomt.
Calciumperchloraat Smeltpunt
Het smeltpunt van Ca(ClO4)2 bedraagt 200°C. Deze temperatuur is het punt waarop vast Ca(ClO4)2 overgaat in een vloeibare toestand. Het smeltpunt is belangrijk bij het bepalen van de fysische eigenschappen van Ca(ClO4)2, zoals het vermogen ervan om als droogmiddel te worden gebruikt.
Dichtheid van calciumperchloraat g/ml
De dichtheid van Ca(ClO4)2 bedraagt 2,505 g/ml. Deze waarde vertegenwoordigt de hoeveelheid massa per volume-eenheid Ca(ClO4)2. De dichtheid van Ca(ClO4)2 is groter dan die van water, waardoor het in water zinkt.
Calciumperchloraat Molecuulgewicht
Het molecuulgewicht van Ca(ClO4)2 bedraagt 238,98 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen in een Ca(ClO4)2-molecuul. Het molecuulgewicht is belangrijk bij het bepalen van de hoeveelheid Ca(ClO4)2 die nodig is voor een bepaalde reactie.
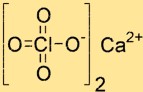
Structuur van calciumperchloraat
De structuur van Ca(ClO4)2 bestaat uit één Ca2+-ion en twee ClO4–ionen. Het Ca2+-ion bevindt zich in het midden van de structuur en is omgeven door vier zuurstofatomen afkomstig van twee ClO4-ionen. De ClO4-ionen zijn tetraëdrisch van vorm en zijn door zuurstofatomen met het calciumion verbonden.
Oplosbaarheid van calciumperchloraat
Ca(ClO4)2 is zeer oplosbaar in water, met een oplosbaarheid van 121 g/100 ml bij 20°C. Deze oplosbaarheid maakt het bruikbaar als droogmiddel omdat het water uit de omgeving kan opnemen. Het is echter onoplosbaar in organische oplosmiddelen zoals ethanol en aceton.
| Verschijning | Witte kristallijne vaste stof |
| Soortelijk gewicht | 2.505 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 238,98 g/mol |
| Dikte | 2.505 g/ml |
| Fusie punt | 200°C |
| Kookpunt | Ontleedt vóór het kookpunt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 121 g/100 ml bij 20°C |
| Oplosbaarheid | Onoplosbaar in organische oplosmiddelen |
| Dampdruk | Niet beschikbaar |
| Dampdichtheid | Niet beschikbaar |
| pKa | Niet beschikbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van calciumperchloraat
Ca(ClO4)2 brengt verschillende veiligheidsrisico’s met zich mee en er moeten passende veiligheidsmaatregelen worden genomen bij het hanteren ervan. Het is een sterk oxidatiemiddel dat kan reageren met brandbare materialen, waardoor brand of explosies kunnen ontstaan. Inademing van stof of damp kan irritatie van de luchtwegen veroorzaken en contact met de huid kan irritatie of brandwonden veroorzaken. Het is ook schadelijk bij inslikken en veroorzaakt irritatie of corrosie van het spijsverteringskanaal. Bij het hanteren van Ca(ClO4)2 moeten adequate persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen en uit de buurt van ontvlambare materialen en onverenigbare stoffen worden bewaard.
| Gevarensymbolen | Oxidatiemiddel, schadelijk bij inslikken |
| Beveiligingsbeschrijving | Verwijderd houden van brandbare materialen en onverenigbare stoffen. Draag handschoenen en een veiligheidsbril. Vermijd inademing van stof of dampen. Bij contact met veel water wassen en indien nodig een arts raadplegen. |
| VN-identificatienummers | UN1502 |
| HS-code | 2829,9000 |
| Gevarenklasse | 5.1 – Oxiderende stoffen |
| Verpakkingsgroep | II |
| Toxiciteit | Schadelijk bij inslikken, irriterend voor de huid en de luchtwegen |
Methoden voor de synthese van calciumperchloraat
Ca(ClO4)2 kan worden gesynthetiseerd door calciumhydroxide te laten reageren met perchloorzuur of ammoniumperchloraat.
Eén methode omvat het laten reageren van calciumcarbonaat met perchloorzuur in een reactievat, gevolgd door filtratie en verdamping van de oplossing om het vaste product te verkrijgen.
Een andere methode omvat de reactie van calciumoxide met een waterige oplossing van perchloorzuur, gevolgd door filtratie en drogen van het resulterende product.
In sommige gevallen kan Ca(ClO4)2 worden gesynthetiseerd door calciumchloride te laten reageren met natriumperchloraat in een reactievat. Het product kan worden gefiltreerd en gedroogd om na de reactie Ca(ClO4)2 te verkrijgen.
Een andere populaire methode voor het synthetiseren van Ca(ClO4)2 is de reactie van calciumchloride met ammoniumperchloraat, waarbij Ca(ClO4)2 en ammoniumchloride als bijproducten ontstaan. Pyrotechnische toepassingen geven de voorkeur aan deze methode vanwege het vermogen om zeer zuiver Ca(ClO4)2 te produceren.
Het is belangrijk op te merken dat bij het werken met perchloorzuur passende veiligheidsmaatregelen moeten worden genomen, aangezien het een sterk oxidatiemiddel is dat kan reageren met organische materialen, waardoor brand of explosies kunnen ontstaan.
Gebruik van calciumperchloraat
Ca(ClO4)2 heeft verschillende toepassingen in diverse industrieën en toepassingen. Enkele toepassingen van Ca(ClO4)2 zijn:
- Pyrotechniek: Vaak gebruikt in pyrotechniek als oxidatiemiddel vanwege het hoge zuurstofgehalte en de stabiliteit.
- Meststof: Wordt gebruikt in meststoffen om planten te voorzien van calcium en chloor, essentiële voedingsstoffen voor hun groei.
- Raketbrandstof: gebruikt als onderdeel van raketbrandstof vanwege het hoge zuurstofgehalte en de stabiliteit.
- Aardolieraffinage: Gebruikt in de aardolie-industrie om zwavelverbindingen uit ruwe olie en andere koolwaterstoffen te verwijderen.
- Airbag-inflators: Gebruikt bij de vervaardiging van airbag-inflators vanwege hun vermogen om snel af te breken en gas te genereren.
- Fakkels: Gebruikt bij de vervaardiging van fakkels vanwege hun hoge zuurstofgehalte en stabiliteit.
- Metaaloppervlaktebehandeling: Gebruikt bij de behandeling van metalen oppervlakken om roest en andere onzuiverheden te verwijderen.
- Laboratoriumtoepassingen: Gebruikt in diverse laboratoriumtoepassingen, zoals bij de bereiding van perchloorzuur en als droogmiddel.
Vragen:
Vraag: Wat is de formule voor calciumperchloraat?
A: Ca(ClO4)2.
Vraag: Is calciumperchloraat ionisch of covalent?
A: Ca(ClO4)2 is een ionische verbinding omdat het bestaat uit calciumkationen (Ca2+) en perchloraatanionen (ClO4-).
Vraag: Hoe gooi ik calciumperchloraat weg?
A: Ca(ClO4)2 kan worden verwijderd door het aangetaste gebied met water te wassen en vervolgens eventuele resterende sporen van de verbinding te neutraliseren met een zwakke base, zoals natriumbicarbonaat.
Vraag: Is calciumperchloraat oplosbaar?
A: Ja, Ca(ClO4)2 is oplosbaar in water en andere polaire oplosmiddelen. De oplosbaarheid in water bedraagt ongeveer 120 g per 100 ml water bij kamertemperatuur.
Vraag: Welke reacties veroorzaken calciumperchloraat en water?
A: Ca(ClO4)2 en water reageren onder normale omstandigheden niet met elkaar.
Vraag: Hoeveel chlooratomen zitten er in 0,650 mol Ca(ClO4)2?
A: Er zijn 5,88 x 10^23 chlooratomen in 0,650 mol Ca(ClO4)2.
Vraag: Wat is de molaire massa van Ca(ClO4)2?
A: De molaire massa van Ca(ClO4)2 is 238,98 g/mol.
Vraag: Wat is de activiteitscoëfficiënt van H in een oplossing die 0,073 M HCl en 0,0090 M Ca(ClO4)2 bevat?
A: De activiteitscoëfficiënt van H in een oplossing die 0,073 M HCl en 0,0090 M Ca(ClO4)2 bevat, hangt af van de temperatuur en andere factoren. Het kan worden berekend met behulp van thermodynamische modellen en experimentele gegevens.
Vraag: Hoeveel mol zit er in 26,0 gram Ca(ClO4)2?
A: Er zitten 0,109 mol Ca(ClO4)2 in 26,0 gram van de verbinding.
