Calciumnitriet (Ca(NO2)2) is een chemische verbinding die vaak wordt gebruikt als corrosieremmer in beton. Het helpt corrosie van stalen wapeningen te voorkomen.
| Naam van IUPAC | Calciumdinitriet |
| Moleculaire formule | Ca(NO2)2 |
| CAS-nummer | 13780-06-8 |
| Synoniemen | Calciumnitrietdihydraat, salpeterigzuur, calciumzout, salpeterzuur, calciumzout, dihydraat, enz. |
| InChi | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Eigenschappen van calciumnitriet
Calciumnitrietformule
De chemische formule voor calciumnitriet is Ca(NO2)2. Deze formule geeft aan dat de verbinding voor elk calciumkation twee nitrietanionen bevat. De formule is belangrijk bij het bepalen van de samenstelling van de verbinding en bij het bepalen van de hoeveelheid van elk element in de verbinding.
Calciumnitriet Molaire massa
De molmassa van Ca(NO2)2, ook wel calciumdinitriet genoemd, bedraagt ongeveer 132,09 g/mol. Het is een ionische verbinding bestaande uit calciumkationen en nitrietanionen. De molaire massa wordt berekend door de atoommassa’s van de samenstellende elementen van de verbinding op te tellen, in dit geval calcium, stikstof en zuurstof.
Kookpunt van calciumnitriet
Ca(NO2)2 heeft een hoog kookpunt van ongeveer 400°C (752°F). Dit hoge kookpunt is te wijten aan de sterke ionische bindingen die bestaan tussen de Ca2+- en NO2–ionen in de verbinding. Wanneer Ca(NO2)2 wordt verwarmd, ondergaat het thermische ontbinding, waarbij stikstofdioxide en zuurstof vrijkomen.
Calciumnitriet Smeltpunt
Ca(NO2)2 heeft een smeltpunt van ongeveer 132°C (270°F). Dit smeltpunt is relatief laag vergeleken met andere ionische verbindingen, zoals natriumchloride, dat een smeltpunt heeft van 801°C (1.474°F). Het lage smeltpunt van Ca(NO2)2 kan worden toegeschreven aan de relatief zwakke ionische bindingen die bestaan tussen de Ca2+- en NO2–ionen.
Dichtheid van calciumnitriet g/ml
De dichtheid van Ca(NO2)2 bedraagt ongeveer 2,32 g/ml. Deze waarde geeft aan dat Ca(NO2)2 een relatief dichte verbinding is. De dichtheid wordt berekend door de massa van de verbinding te delen door het volume. De hoge dichtheid van Ca(NO2)2 kan worden toegeschreven aan de aanwezigheid van relatief zware calciumkationen.
Calciumnitriet Molecuulgewicht
Het molecuulgewicht van Ca(NO2)2 bedraagt ongeveer 132,09 g/mol. Deze waarde wordt berekend door de atoomgewichten van de samenstellende elementen van de verbinding op te tellen. Het molecuulgewicht is belangrijk bij het bepalen van de hoeveelheid Ca(NO2)2 die nodig is om een bepaald aantal mol van de verbinding te verkrijgen.
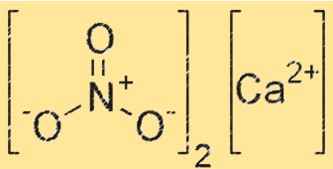
Structuur van calciumnitriet
De structuur van Ca(NO2)2 bestaat uit Ca2+ en NO2-. Ca2+-ionen bevinden zich in het midden van het kristalrooster, terwijl NO2-ionen deze omringen. Het kristalrooster wordt bij elkaar gehouden door sterke ionische bindingen tussen Ca2+- en NO2–ionen.
Oplosbaarheid van calciumnitriet
Ca(NO2)2 is oplosbaar in water en alcohol. De wateroplosbaarheid is relatief hoog, met een oplosbaarheid van ongeveer 61 g/100 ml water bij kamertemperatuur. De oplosbaarheid in alcohol is lager dan die in water. De oplosbaarheid van Ca(NO2)2 is van belang bij het bepalen van het gebruik ervan in diverse toepassingen, zoals bij de productie van beton.
| Verschijning | Wit tot lichtgeel kristallijn poeder of vaste stof |
| Soortelijk gewicht | 2.32 |
| Kleur | Kleurloos tot wit |
| Geur | Geurloos |
| Molaire massa | 132,09 g/mol |
| Dikte | 2,32 g/ml |
| Fusie punt | 132°C (270°F) |
| Kookpunt | Ontleedt bij ongeveer 400°C (752°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water en alcohol |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Neutrale |
Veiligheid en gevaren van calciumnitriet
Ca(NO2)2 kan schadelijk zijn bij inslikken, inademen of bij contact met de huid of ogen. Dit kan irritatie, brandwonden en ademhalingsproblemen veroorzaken. De verbinding is ook een oxidatiemiddel en kan reageren met andere chemicaliën, zoals zuren en metalen, om gevaarlijke stoffen te vormen. Ca(NO2)2 moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare materialen. Bij het hanteren van de verbinding moeten persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen. Bij blootstelling moet onmiddellijk medische hulp worden ingeroepen en moet verontreinigde kleding worden verwijderd.
| Gevarensymbolen | Xn |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen; draag persoonlijke beschermingsmiddelen (PBM); Bij blootstelling dient u onmiddellijk medische hulp in te roepen. |
| VN-identificatienummers | VN 1454 |
| HS-code | 2834.29.90 |
| Gevarenklasse | 5.1 |
| Verpakkingsgroep | III |
| Toxiciteit | Schadelijk bij inslikken of inademen; kan irritatie, brandwonden en ademhalingsproblemen veroorzaken |
Synthesemethoden voor calciumnitriet
Verschillende methoden kunnen Ca(NO2)2 synthetiseren, waaronder de reactie van salpeterzuur of stikstofoxiden met calciumcarbonaat , de reactie van salpeterigzuur of stikstofoxiden met koolstofhydroxide. calcium en de reactie van calciumhydroxide of ammoniumhydroxide met calciumnitraat.
Een gebruikelijke methode is om calciumcarbonaat te laten reageren met salpeterzuur om calciumnitraat te produceren. Vervolgens resulteert de reactie van calciumnitraat met calciumhydroxide in de vorming van Ca(NO2)2 en calciumoxide-bijproducten.
Een andere methode omvat de reactie van stikstofoxiden met calciumhydroxide om Ca(NO2)2 en calciumnitraat te produceren.
Bij een andere methode kan men calciumnitraat laten reageren met calciumhydroxide of ammoniumhydroxide om Ca(NO2)2 te produceren, terwijl calciumnitraat als bijproduct ontstaat.
Gebruik van calciumnitriet
Ca(NO2)2 kent diverse toepassingen in verschillende industrieën, waaronder:
- Betonindustrie: Gebruikt als additief voor beton om de duurzaamheid en sterkte van betonconstructies te vergroten. Het werkt als een corrosieremmer en beschermt wapeningsstaal tegen corrosie veroorzaakt door chloriden en andere agressieve ionen.
- Landbouw: Gebruikt als meststof in de landbouw om planten van stikstof en calcium te voorzien. Wordt ook gebruikt als bodemverbeteraar om de bodemkwaliteit te verbeteren en de plantengroei te bevorderen.
- Chemische industrie: gebruikt als reductiemiddel bij chemische reacties, maar ook als voorloper voor de synthese van andere chemicaliën zoals calciumnitraat en calciumammoniumnitraat.
- Afvalwaterbehandeling: Gebruikt als chemische stof voor de behandeling van afvalwater om verontreinigingen te verwijderen en de concentratie van schadelijke stoffen in water te verminderen.
- Voedingsindustrie: gebruikt als voedselconserveermiddel om de groei van bacteriën en andere micro-organismen in vlees, vis en andere voedingsproducten te voorkomen.
Vragen:
Vraag: Wat is de formule voor calciumnitriet?
A: De chemische formule voor calciumnitriet is Ca(NO2)2.
Vraag: Hoeveel calciumnitriet wordt er jaarlijks in beton gebruikt?
A: De hoeveelheid Ca(NO2)2 die jaarlijks in beton wordt gebruikt, varieert afhankelijk van de specifieke toepassing en de marktvraag. Er wordt echter geschat dat er wereldwijd jaarlijks enkele duizenden tonnen Ca(NO2)2 als betonadditief worden gebruikt.
Vraag: Is calciumnitriet oplosbaar in water?
A: Ja, Ca(NO2)2 is oplosbaar in water. Het heeft een oplosbaarheid van ongeveer 167 g/l bij 20°C.
Vraag: Is calciumnitriet een zout?
A: Ja, Ca(NO2)2 is zout. Een ionische verbinding bestaande uit calciumkationen (Ca2+) en nitrietanionen (NO2-).
Vraag: Hoe zouden de volgende oplossingen worden voorbereid? 1,25 l van een 0,775 m oplossing van Ca(NO2)2
A: Om 1,25 L van een 0,775 M oplossing van Ca(NO2)2 te bereiden, moet u ongeveer 187,5 g Ca(NO2)2 oplossen in voldoende water om een eindvolume van 1,25 L te verkrijgen. Dit kan worden berekend met behulp van de formule formule: gram opgeloste stof = Molariteit x volume (in liters) x molaire massa opgeloste stof.
Vraag: Wat is de ionische samenstellingsformule voor calciumnitriet?
A: De formule van de ionische verbinding voor Ca(NO2)2 is Ca(NO2)2. Het bestaat uit één calciumion (Ca2+) en twee nitrietionen (NO2-).
