Calciumfosfaat (Ca3(PO4)2) is een mineraal dat voorkomt in tanden en botten. Dit helpt hen sterk en gezond te maken. Het wordt ook gebruikt als voedingssupplement om calciumgebrek te voorkomen.
| IUPAC-naam | Calciumfosfaat |
| Moleculaire formule | Ca3(PO4)2 |
| CAS-nummer | 7758-87-4 |
| Synoniemen | Tricalciumfosfaat, botfosfaat, calciumorthofosfaat, tribasisch calciumfosfaat, TCP |
| InChi | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Eigenschappen van calciumfosfaat
Calciumfosfaatformule
De chemische formule voor calciumfosfaat is Ca3(PO4)2, wat aangeeft dat het drie calciumionen en twee fosfaationen bevat. De formule wordt gebruikt om de hoeveelheid calciumfosfaat te berekenen die nodig is voor chemische reacties. Calciumfosfaat is een belangrijk onderdeel van tanden en botten en wordt ook gebruikt in verschillende industriële toepassingen, zoals voedseladditieven en meststoffen.
Calciumfosfaat molaire massa
De molaire massa van Ca3(PO4)2 bedraagt 310,18 g/mol. Het wordt berekend door de atoommassa van calcium, fosfor en zuurstof toe te voegen, die respectievelijk 40,08 g/mol, 30,97 g/mol en 15,99 g/mol zijn. Molaire massa is een belangrijke parameter bij het bepalen van de hoeveelheid Ca3(PO4)2 die nodig is bij een chemische reactie.
Kookpunt van calciumfosfaat
Ca3(PO4)2 heeft geen duidelijk kookpunt, omdat het ontleedt voordat het zijn kookpunt bereikt. Bij verhitting valt Ca3(PO4)2 uiteen in calciumoxide en fosforpentoxide, waarbij waterdamp vrijkomt. De ontledingstemperatuur is afhankelijk van het type Ca3(PO4)2 en de verwarmingssnelheid.
Smeltpunt van calciumfosfaat
Het smeltpunt van Ca3(PO4)2 is afhankelijk van het type Ca3(PO4)2. Het smeltpunt van tricalciumfosfaat, de meest voorkomende vorm van Ca3(PO4)2 in de natuur, ligt ongeveer 1670°C. Dicalciumfosfaat heeft een smeltpunt van ongeveer 1400°C, terwijl monocalciumfosfaat smelt rond de 109°C.
Dichtheid van calciumfosfaat g/ml
De dichtheid van Ca3(PO4)2 varieert afhankelijk van het type Ca3(PO4)2. Tricalciumfosfaat heeft een dichtheid van ongeveer 3,14 g/ml, terwijl dicalciumfosfaat een dichtheid heeft van ongeveer 2,31 g/ml. Monocalciumfosfaat heeft een dichtheid van ongeveer 2,22 g/ml.
Calciumfosfaat Molecuulgewicht
Het molecuulgewicht van Ca3(PO4)2 bedraagt 310,18 g/mol, wat overeenkomt met de som van de atoomgewichten van calcium, fosfor en zuurstof. Het molecuulgewicht is belangrijk voor het berekenen van de hoeveelheid Ca3(PO4)2 die nodig is voor chemische reacties.
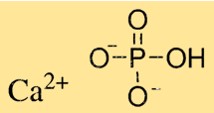
Structuur van calciumfosfaat
Ca3(PO4)2 heeft een complexe kristalstructuur die afhangt van het type Ca3(PO4)2. Tricalciumfosfaat heeft een hexagonale kristalstructuur, terwijl dicalciumfosfaat een monokliene kristalstructuur heeft. Monocalciumfosfaat heeft een tetragonale kristalstructuur. Ca3(PO4)2-kristallen zijn samengesteld uit calciumionen en fosfaationen die in een specifiek patroon zijn gerangschikt.
| Verschijning | Wit poeder of kristallen |
| Soortelijk gewicht | 3.14 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 310,18 g/mol |
| Dikte | 3,14 g/ml (tricalciumfosfaat) |
| Fusie punt | 1670 °C (tricalciumfosfaat) |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | N.v.t |
| oplosbaarheid in water | 0,002 g/100 ml (bij 25°C) |
| Oplosbaarheid | Oplosbaar in zuren, onoplosbaar in water |
| Dampdruk | N.v.t |
| Dampdichtheid | N.v.t |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH | 5,5-7,5 (10% suspensie in water) |
Veiligheid en gevaren van calciumfosfaat
Ca3(PO4)2 wordt over het algemeen als veilig voor menselijke consumptie beschouwd en brengt geen significante gezondheidsrisico’s met zich mee. Het is een natuurlijk mineraal dat voorkomt in botten en tanden en dat in vele vormen als voedingssupplement wordt gebruikt. Ca3(PO4)2 wordt ook in de voedingsindustrie gebruikt als voedingsadditief en deegconditioner. Overmatige consumptie van Ca3(PO4)2-supplementen kan echter leiden tot nadelige effecten, zoals maagklachten, obstipatie en zelfs nierbeschadiging. Bovendien kan blootstelling aan hoge niveaus van Ca3(PO4)2-stof op de werkplek ademhalingsproblemen veroorzaken. Daarom is het belangrijk om Ca3(PO4)2-supplementen en -producten met mate te gebruiken en de industriële veiligheidsrichtlijnen te volgen.
| Gevarensymbolen | Geen bekend |
| Beveiligingsbeschrijving | 26-36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| VN-identificatienummers | N.v.t |
| HS-code | 28352500 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit |
Methoden voor de synthese van calciumfosfaat
Er zijn verschillende methoden voor de synthese van Ca3(PO4)2, waaronder precipitatie, hydrothermische synthese, sol-gelproces en vastestofreactie.
De precipitatiemethode omvat het combineren van calcium- en fosfaationen in een waterige oplossing, wat resulteert in de vorming van een neerslag door middel van een chemische reactie. De onderzoeker wast en droogt vervolgens het neerslag om de gewenste Ca3(PO4)2-verbinding te verkrijgen.
Hydrothermische synthese omvat de reactie van calcium- en fosfaatbronnen in een omgeving met hoge druk en hoge temperaturen. Om de gewenste Ca3(PO4)2-verbinding te verkrijgen, wordt het resulterende product gewassen en gedroogd.
Bij het sol-gelproces wordt een sol, of colloïdale suspensie, omgezet in een gel en vervolgens gedroogd om de gewenste Ca3(PO4)2-verbinding te verkrijgen. Deze methode maakt nauwkeurige controle van de samenstelling en morfologie van de verkregen verbinding mogelijk.
De reactie in de vaste toestand omvat het mengen van calciumpyrofosfaat en calciumcarbonaat in de vaste toestand en het vervolgens verwarmen van het mengsel om een chemische reactie te bevorderen. Om de gewenste Ca3(PO4)2-verbinding te verkrijgen, moet het verkregen product worden gewassen en gedroogd.
Gebruik van calciumfosfaat
Ca3(PO4)2 heeft vanwege zijn unieke eigenschappen vele toepassingen in verschillende industrieën. Enkele veel voorkomende toepassingen van Ca3(PO4)2 zijn:
- Voedingssupplementen: Vaak gebruikt in voedingssupplementen als bron van calcium en fosfor, essentiële mineralen voor de gezondheid van de botten.
- Voedings- en drankenindustrie: wordt gebruikt als voedingsadditief in veel bewerkte voedingsmiddelen, waaronder gebak, zuivelproducten en dranken. Bij het bakken gebruiken mensen het als vertrekkende stof en als bron van calcium.
- Farmaceutische Industrie: Gebruikt in de farmaceutische industrie als vulmiddel en bindmiddel in tabletten en capsules. Van sommige geneesmiddelen kan de biologische beschikbaarheid worden verbeterd door ze als coatingmiddel te gebruiken.
- Landbouw: Gebruikt als meststof om planten te voorzien van essentiële voedingsstoffen zoals calcium en fosfor.
- Tandheelkunde: Gebruikt in de tandheelkunde om tanden te remineraliseren en tandglazuur te herstellen.
- Biomedische technologie: Wordt ook gebruikt in de biomedische technologie om vervangingsmiddelen voor bottransplantaten te ontwikkelen en om de eigenschappen te verbeteren van biomaterialen die worden gebruikt bij de botweefselengineering.
Vragen:
Vraag: Waarom verhoogt het toevoegen van zuur de oplosbaarheid van calciumfosfaat?
A: Het toevoegen van zuur verhoogt de oplosbaarheid van Ca3(PO4)2 door de fosfaationen te protoneren, waardoor ze beter oplosbaar worden in water. Geprotoneerde fosfaationen vormen het zure Ca3(PO4)2, dat beter oplosbaar is dan de neutrale vorm.
Vraag: Hoeveel gram fosfor zit er in 500,0 gram calciumfosfaat?
A: De molaire massa van Ca3(PO4)2 is 310,18 g/mol. De verbinding heeft een fosfor/calciumverhouding van 2:3, dus de molmassa van fosfor is 30,97 g/mol. In 500,0 gram Ca3(PO4)2 zit dus 81,62 gram fosfor.
Vraag: Is calciumfosfaat oplosbaar?
A: Ca3(PO4)2 heeft een lage oplosbaarheid in water, met een productoplosbaarheid van 1,8 x 10^-29. De oplosbaarheid ervan kan echter worden verhoogd door de toevoeging van zuren.
Vraag: Wat is het massapercentage zuurstof in calciumfosfaat?
A: De molaire massa van Ca3(PO4)2 is 310,18 g/mol. De atoommassa van zuurstof is 16,00 g/mol en er zitten 8 zuurstofatomen in één mol Ca3(PO4)2. Daarom is de zuurstofmassa in één mol Ca3(PO4)2 8 x 16,00 = 128,00 g. De massa van Ca3(PO4)2 is 310,18 g, dus het massapercentage zuurstof is (128,00 g / 310,18 g) x 100% = 41,23%.
Vraag: Is Ca3(PO4)2 oplosbaar in water?
A: Ca3(PO4)2 is niet erg oplosbaar in water, met een productoplosbaarheid van 1,3 x 10^-33.
Vraag: Wat is de molaire massa van Ca3(PO4)2?
A: De molaire massa van Ca3(PO4)2 is 310,18 g/mol.
Vraag: Wat is Ca3(PO4)2?
A: Ca3(PO4)2 is een chemische verbinding die bestaat uit drie Ca2+-ionen en twee PO43-ionen. Het is een wit poeder, geurloos en onoplosbaar in water.
Vraag: Wat is de formulemassa in gram Ca3(PO4)2?
A: De formulemassa in gram Ca3(PO4)2 is 310,18 g/mol.
