Calciumchloride is een zeer oplosbare anorganische verbinding met de formule CaCl2. Het wordt vaak gebruikt als ontijzingsmiddel, droogmiddel en bij de productie van calciumzouten en chemicaliën.
| IUPAC-naam | Calciumchloride |
| Moleculaire formule | CaCl2 |
| CAS-nummer | 10043-52-4 |
| Synoniemen | Calciumdichloride, calcium(II)chloride |
| E509, beitszout, Dowflake, Peladow, TETRA | |
| InChi | InChI=1S/Ca.2ClH/u;2*1H/q+2;;/p-2 |
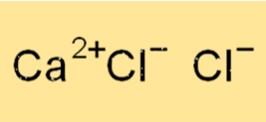
Calciumchloride-formule
De chemische formule voor calciumchloride is CaCl2. Dit betekent dat elke eenheid calciumchloride bestaat uit één calciumion (Ca2+) en twee chloride-ionen (Cl-). Calciumchloride is een ionische verbinding, wat betekent dat het bij elkaar wordt gehouden door elektrostatische aantrekking tussen het positief geladen calciumion en de negatief geladen chloride-ionen.
Molaire massa calciumchloride
Calciumchloride heeft een molmassa van 110,98 g/mol, wat overeenkomt met de som van de atoommassa’s van één Ca-atoom en twee Cl-atomen. Het is een anorganische verbinding die zeer goed oplosbaar is in water. water en wordt vaak gebruikt als droogmiddel, droogmiddel en ontijzingsmiddel. Calciumchloride wordt ook gebruikt bij de productie van calciumzouten en andere chemicaliën.
Kookpunt van CaCl2
Het kookpunt van CaCl2 is 1935°C, wat erg hoog is voor een anorganische verbinding. Dit komt door de sterke ionische bindingen tussen de Ca+2- en Cl-ionen, die veel energie nodig hebben om te breken. CaCl2 is een hygroscopische verbinding, wat betekent dat het vocht uit de lucht absorbeert en in water kan oplossen om een sterk geconcentreerde oplossing te vormen.
Smeltpunt van CaCl2
CaCl2 heeft een smeltpunt van 772°C. Het heeft een kristallijne structuur en wordt meestal in watervrije vorm aangetroffen, wat betekent dat het geen watermoleculen bevat. Wanneer CaCl2 wordt verwarmd, valt het uiteen in calciumoxide en waterstofchloridegas.
Dichtheid van CaCl2 g/ml
De dichtheid van CaCl2 hangt af van de concentratie van de oplossing. Een 1 M oplossing van CaCl2 heeft een dichtheid van ongeveer 1,4 g/ml, terwijl een 3 M oplossing een dichtheid heeft van ongeveer 1,6 g/ml. De dichtheid van vast CaCl2 is 2,15 g/cm³.
Molecuulgewicht van CaCl2
Het molecuulgewicht van CaCl2 bedraagt 110,98 g/mol. Het is een anorganische verbinding bestaande uit één Ca-atoom en twee Cl-atomen. CaCl2 is bij kamertemperatuur een witte kristallijne vaste stof en is zeer oplosbaar in water.
Structuur van CaCl2
CaCl2 heeft een kristalroosterstructuur, die bij elkaar wordt gehouden door ionische bindingen tussen het calciumkation (Ca2+) en het chloride-anion (Cl-). Elk Ca+2-ion is omgeven door zes Cl-ionen en elk chloride-ion is omgeven door zes calciumionen. De kristalstructuur van CaCl2 is kubisch, waarbij elke eenheidscel één calciumion en twee chloride-ionen bevat.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 2,15 (vast), 1,4-1,6 (oplossing) |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 110,98 g/mol |
| Dikte | 2,15 g/cm³ (vast), 1,4-1,6 g/cm³ (oplossing) |
| Fusie punt | 772°C |
| Kookpunt | 1935°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Zeer oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol en aceton |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | – |
| pH | 4,5-11,0 (10% oplossing) |
Veiligheid en gevaren van calciumchloride
CaCl2 kan huid- en oogirritatie veroorzaken, en het inademen van het stof of de nevel ervan kan irritatie van de luchtwegen veroorzaken. Het kan ook brandwonden veroorzaken als het in contact komt met de huid of ogen. CaCl2 is hygroscopisch, wat betekent dat het vocht kan absorberen en warmte kan afgeven, waardoor containers kunnen scheuren of exploderen. Het is ook corrosief voor bepaalde metalen en kan reageren met bepaalde organische materialen. Bij het hanteren van CaCl2 moeten geschikte beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gebruikt. Gemorst materiaal moet onmiddellijk worden opgeruimd en containers moeten worden opgeslagen in een koele, droge, goed geventileerde ruimte.
| Gevarensymbolen | Bijtend, irriterend |
| Beveiligingsbeschrijving | Draag beschermende handschoenen en oog-/gezichtsbescherming. Stof/rook/gas/nevel/dampen niet inademen. |
| VN-identificatienummers | UN 3077, UN 1786 (ounce gehydrateerd) |
| HS-code | 2827.39.90 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | III |
| Toxiciteit | De toxiciteit is voor de meeste toepassingen laag, maar kan in grote hoeveelheden gevaarlijk zijn |
Methoden voor de synthese van calciumchloride
Om CaCl2 te synthetiseren zijn er verschillende methoden beschikbaar.
Eén methode omvat het laten reageren van calciumcarbonaat of calciumhydroxide met zoutzuur . Eén methode is het toevoegen van calciumcarbonaat of calciumhydroxide aan zoutzuur . De oplossing verdampt en geeft CaCl2.
Een andere methode is om calciumoxide te laten reageren met zoutzuur . Deze methode omvat het toevoegen van calciumoxide aan zoutzuur en het vervolgens verdampen van de oplossing om CaCl2 te verkrijgen.
Een derde methode omvat het laten reageren van metallisch calcium met chloorgas . Een minder gebruikelijke methode is het verwarmen van calciummetaal in aanwezigheid van chloorgas. De reactie produceert CaCl2, maar experts gebruiken deze aanpak niet vaak vanwege de hoge reactiviteit van calciummetaal en de behoefte aan gespecialiseerde behandeling.
Om CaCl2 op een andere manier te produceren, kan men het bijproduct van het Solvay-proces gebruiken, dat natriumchloride en CaCl2 genereert. Het proces omvat het extraheren van CaCl2 uit het bijproduct door middel van filtratie-, verdampings- en zuiveringstechnieken. Deze stappen helpen alle onzuiverheden te verwijderen en CaCl2 met een hoge zuiverheid te produceren.
Gebruik van calciumchloride
CaCl2 heeft veel industriële toepassingen:
- Gebruikt als droogmiddel om vocht te absorberen, als ontdooimiddel voor wegen en trottoirs, en als stollingsmiddel bij de productie van tofu en ander voedsel.
- Gebruikt in de olie- en gasindustrie om de dichtheid van boorvloeistoffen te verhogen en het vriespunt van water in pijpleidingen te verlagen.
- Gebruikt in betonmengsels om het uithardingsproces te versnellen en de sterkte en duurzaamheid van het eindproduct te vergroten.
- Gebruikt bij de papierproductie om de sterkte en stabiliteit van papiervezels te vergroten.
- Gebruikt bij waterbehandeling om onzuiverheden te verwijderen en water te verzachten.
- Gebruikt als bron van calciumionen in medische toepassingen, zoals intraveneuze vloeistoffen en om hypocalciëmie te behandelen.
- Gebruikt bij de productie van kunststoffen en rubber om de hardheid en duurzaamheid van het eindproduct te vergroten.
- Wordt gebruikt bij het conserveren van fruit en groenten om bederf te voorkomen en om de textuur en smaak van het product te behouden.
- Gebruikt bij de textielproductie om de kleurstofabsorptie te verbeteren en de vezelsterkte en flexibiliteit te vergroten.
- Wordt ook gebruikt bij de productie van brandblussers en als onderdeel van vlamvertragende materialen om de verspreiding van vlammen te voorkomen.
Vragen:
Vraag: Wat is calciumchloride?
A: Calciumchloride is een chemische verbinding bestaande uit Ca2+ en Cl-ionen met de chemische formule CaCl2.
Vraag: Is calciumchloride ionisch of covalent?
A: CaCl2 is een ionische verbinding omdat het bestaat uit positief geladen Ca2+-ionen en negatief geladen Cl-ionen, bij elkaar gehouden door ionische bindingen.
Vraag: Waar wordt calciumchloride voor gebruikt?
A: CaCl2 heeft veel industriële, commerciële en medische toepassingen, waaronder als droogmiddel, ontijzingsmiddel, coagulatiemiddel bij de voedselproductie, versneller in beton, waterontharder en bron van calciumionen bij medische behandelingen.
Vraag: Wat is de formule voor calciumchloride?
A: De formule voor calciumchloride is CaCl2, wat aangeeft dat elk molecuul één calciumion en twee chloride-ionen bevat.
Vraag: Is CaCl2 ionisch of covalent?
A: CaCl2 is een ionische verbinding omdat het bestaat uit positief geladen calciumionen en negatief geladen chloride-ionen, bij elkaar gehouden door ionische bindingen.
Vraag: Is CaCl2 oplosbaar in water?
A: Ja, CaCl2 is zeer oplosbaar in water, wat betekent dat het gemakkelijk in water kan oplossen om een heldere oplossing te vormen.
Vraag: Als CaCl2 in water wordt opgelost, wat kunnen we dan zeggen over de concentratie van het Ca2+-ion?
A: Wanneer CaCl2 in water wordt opgelost, valt het uiteen in de samenstellende ionen, Ca2+ en 2Cl-. Omdat CaCl2 volledig dissocieert in water, is de concentratie van Ca2+-ionen in oplossing tweemaal de concentratie van CaCl2.
