Calciumcarbonaat is een chemische verbinding met de formule CaCO3. Het wordt vaak aangetroffen in rotsen en schelpen en wordt gebruikt bij de productie van cement, verf en voedingssupplementen.
| IUPAC-naam | Calciumcarbonaat |
| Moleculaire formule | CaCO3 |
| CAS-nummer | 471-34-1 |
| Synoniemen | Kalksteen, krijt, calciet, aragoniet, marmer, neergeslagen calciumcarbonaat, calciumzout van koolzuur (1:1) |
| InChi | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
CaCO3 Molaire massa
De molaire massa van calciumcarbonaat is 100,09 g/mol. Dit betekent dat één mol calciumcarbonaat 100,09 gram van de verbinding bevat. Molaire massa is belangrijk bij stoichiometrische berekeningen omdat het conversie van mol naar gram mogelijk maakt of omgekeerd.
Calciumcarbonaatformule
De chemische formule voor calciumcarbonaat is CaCO₃. Dit betekent dat elk calciumcarbonaatmolecuul één calciumatoom, één koolstofatoom en drie zuurstofatomen bevat. De formule is belangrijk voor het bepalen van de hoeveelheid calciumcarbonaat die nodig is voor een specifieke toepassing en voor het begrijpen van de chemische eigenschappen ervan.
Kookpunt van calciumcarbonaat
Calciumcarbonaat heeft geen kookpunt omdat het ontleedt voordat het zijn kookpunt bereikt. Bij atmosferische druk valt calciumcarbonaat uiteen in calciumoxide en kooldioxide bij temperaturen boven 825°C. Daarom wordt calciumcarbonaat vaak gebruikt bij toepassingen bij hoge temperaturen, zoals bij de cementproductie.
Smeltpunt van calciumcarbonaat
Het smeltpunt van calciumcarbonaat is 1339°C. Bij deze temperatuur ondergaat calciumcarbonaat thermische ontleding om calciumoxide en kooldioxide te vormen. Het smeltpunt is belangrijk voor het begrijpen van het gedrag van calciumcarbonaat bij hoge temperaturen.
Dichtheid van calciumcarbonaat g/ml
De dichtheid van calciumcarbonaat is 2,71 g/cm³. Dit betekent dat calciumcarbonaat een hogere dichtheid heeft dan water en zal zinken als het in water wordt geplaatst. Dichtheid is belangrijk voor het begrijpen van de fysische eigenschappen van calciumcarbonaat en voor het bepalen van het gebruik ervan in verschillende toepassingen.
Calciumcarbonaat Molecuulgewicht
Het molecuulgewicht van calciumcarbonaat is 100,09 g/mol. Dit betekent dat de verbinding bestaat uit één calciumatoom, één koolstofatoom en drie zuurstofatomen. Het molecuulgewicht is belangrijk voor het bepalen van de hoeveelheid calciumcarbonaat die nodig is voor een specifieke toepassing en voor het begrijpen van de chemische eigenschappen ervan.
Structuur van calciumcarbonaat
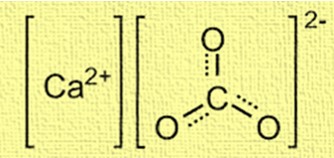
De structuur van calciumcarbonaat is kristallijn en bestaat uit calciumionen (Ca²⁺) en carbonaationen (CO₃²⁻). Calciumionen bevinden zich in het midden van de structuur en zijn omgeven door zes carbonaationen. De carbonaationen zijn gerangschikt in een trigonale vlakke vorm, waarbij elk zuurstofatoom door een dubbele binding met het koolstofatoom is verbonden. De structuur is belangrijk voor het begrijpen van het gedrag van calciumcarbonaat bij verschillende toepassingen, zoals de vorming van schelpen en koraalriffen.
| Verschijning | Wit poeder of kleurloos kristal |
| Soortelijk gewicht | 2.71 |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 100,09 g/mol |
| Dikte | 2,71 g/cm³ |
| Fusie punt | 1339°C |
| Kookpunt | Breekt af voordat het kookt |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | 0,0013 g/100 ml (25°C) |
| Oplosbaarheid | Onoplosbaar in water en de meeste organische oplosmiddelen |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 9.00 uur (eerste); 11,8 (tweede) |
| pH | 9,3 – 9,7 (0,1 M waterige oplossing) |
Veiligheid en gevaren van calciumcarbonaat
Calciumcarbonaat wordt over het algemeen als veilig beschouwd voor mens en milieu als het wordt gebruikt zoals voorgeschreven. Het inademen van calciumcarbonaatstof kan echter irritatie van de luchtwegen, ogen en huid veroorzaken. Langdurige blootstelling aan hoge concentraties calciumcarbonaatstof kan longschade veroorzaken. Calciumcarbonaat kan ook reageren met sterke zuren en kooldioxide produceren, wat in bepaalde situaties brand- of explosiegevaar kan veroorzaken. Het is belangrijk om de juiste veiligheidsprocedures te volgen bij het hanteren van calciumcarbonaat, zoals het dragen van beschermende uitrusting en het zorgen voor voldoende ventilatie.
| Gevarensymbolen | Niet toepasbaar |
| Beveiligingsbeschrijving | Vermijd inademing van stof. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet gereguleerd |
| HS-code | 2836.50.00 |
| Gevarenklasse | Niet gereguleerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit voor mens en milieu |
Synthesemethoden voor calciumcarbonaat
Verschillende methoden kunnen calciumcarbonaat (CaCo3) synthetiseren, waaronder precipitatie-, carbonatatie- en sol-gel-methoden.
De precipitatiemethode omvat het mengen van calciumhydroxide met een oplosbaar carbonaatzout, zoals natriumcarbonaat , onder gecontroleerde omstandigheden om een CaC03-neerslag te vormen. Om het eindproduct te verkrijgen, moet het neerslag worden gefilterd en gedroogd.
De carbonatatiemethode omvat het laten reageren van calciumoxide met kooldioxide onder hoge druk en temperatuur om CaCo3 te produceren. De reactie moet worden uitgevoerd in een gesloten systeem om het ontsnappen van kooldioxide te voorkomen. Vervolgens moet eventueel niet-gereageerd calciumoxide of kooldioxide worden gescheiden van het resulterende CaCo3 en gezuiverd.
De sol-gel-methode omvat de hydrolyse en condensatie van een calciumhoudende precursor, zoals calciumalkoxide of calciumnitraat, in aanwezigheid van een oplosmiddel en een katalysator. Om CaCo3 te produceren moet de verkregen gel worden gedroogd en gecalcineerd.
De CaCo3-synthesemethode omvat het gebruik van biomineralisatie, waarbij levende organismen zoals koralen of oesterschelpen CaCo3-kristallen genereren. Operators verzamelen deze kristallen en verwerken ze tot het eindproduct.
Elke methode heeft zijn eigen voor- en nadelen, en de keuze van de methode hangt af van factoren zoals kosten, zuiverheid en gewenste deeltjesgrootte van het eindproduct.
Gebruik van calciumcarbonaat
Calciumcarbonaat heeft vele toepassingen in verschillende industrieën, vanwege zijn eigenschappen zoals lage toxiciteit, hoge zuiverheid en lage beschikbaarheid. Enkele veel voorkomende toepassingen van calciumcarbonaat zijn:
- Constructie: Gebruikt als bouwmateriaal in de vorm van kalksteen, marmer en krijt. Gebruikt als vulmiddel om de sterkte en duurzaamheid van cement, mortel en beton te verbeteren.
- Geneesmiddelen: gebruikt bij de productie van maagzuurremmers en calciumsupplementen. Gebruikt als hulpstof bij de formulering van tabletten en capsules.
- Voedsel en drank: Gebruikt als voedingsadditief om calcium te versterken en als pH-regelaar in dranken.
- Papier en pulp: Gebruikt als vulmiddel en coatingmiddel bij de productie van papier en karton, om de bedrukbaarheid en witheid te verbeteren.
- Kunststoffen: Gebruikt als vulmiddel en versterking in kunststofproducten, om hun mechanische eigenschappen te verbeteren en de kosten te verlagen.
- Verven en coatings: Gebruikt als pigment en vulmiddel in verven en coatings, om hun dekking en dekking te verbeteren.
- Landbouw: Gebruikt als bodemverbetering om de bodemkwaliteit en de gewasgroei te verbeteren.
- Waterbehandeling: Wordt gebruikt om zuur water te neutraliseren en onzuiverheden uit water te verwijderen.
Dit zijn enkele van de meest voorkomende toepassingen van calciumcarbonaat, maar er zijn nog veel meer toepassingen in verschillende industrieën.
Vragen:
Vraag: Is calciumcarbonaat oplosbaar in water?
A: Calciumcarbonaat heeft een lage oplosbaarheid in water, met een oplosbaarheid van ongeveer 0,0013 g/100 ml bij 25°C.
Vraag: Wat is calciumcarbonaat?
A: Calciumcarbonaat is een chemische verbinding met de formule CaCO3. Het is een veel voorkomende stof die wordt aangetroffen in rotsen, schelpen van mariene organismen en in verschillende minerale afzettingen.
Vraag: Waar kun je calciumcarbonaat vinden?
A: Calciumcarbonaat is te vinden in verschillende natuurlijke bronnen zoals kalksteen, krijt en marmer. Het wordt ook aangetroffen in de schelpen van mariene organismen zoals oesters, mosselen en koralen.
Vraag: Is calciumcarbonaat ionisch of covalent?
A: Calciumcarbonaat is een ionische verbinding bestaande uit een calciumkation (Ca2+) en een carbonaatanion (CO32-).
Vraag: Calciumcarbonaat is een soort gehydrogeneerd sediment dat kan worden begraven en verhard tot _____.
A: Calciumcarbonaat is een soort gehydrogeneerd sediment dat kan worden begraven en verhard tot kalksteen.
Vraag: De gelaagde structuren gemaakt van calciumcarbonaat door Precambriaanse cyanobacteriën worden _____ genoemd.
A: De gelaagde structuren gemaakt van calciumcarbonaat door Precambriaanse cyanobacteriën worden stromatolieten genoemd.
