Calciumcarbide is een chemische verbinding met de formule CaC2. Het wordt voornamelijk gebruikt voor de productie van acetyleengas en calciumcyanamide. Het reageert met water en produceert acetyleengas en calciumhydroxide. Mensen gebruiken het voor lassen en verlichting.
| Naam van IUPAC | Calciumethyndiide |
| Moleculaire formule | CaC2 |
| CAS-nummer | 75-20-7 |
| Synoniemen | Calciumacetylide, calciumperkoolstof, calciumdicarbide, calciumcarburo, carburo calcico, calciumethynediide |
| InChi | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Eigenschappen van calciumcarbide
Calciumcarbide-formule
De chemische formule voor calciumcarbide is CaC2. Dit betekent dat een calciumcarbidemolecuul bestaat uit één calciumatoom en twee koolstofatomen. De formule toont de verhouding van de elementen van de verbinding.
Molaire massa calciumcarbide
De molaire massa van CaC2 is 64,099 g/mol. Dit betekent dat één mol CaC2 een massa heeft van 64.099 gram. De molaire massa wordt berekend door de atoommassa’s van de elementen in de formule op te tellen. De atoommassa van calcium is 40,078 g/mol en die van koolstof 12,011 g/mol.
Kookpunt van calciumcarbide
Het kookpunt van CaC2 is 2300°C. Dit betekent dat CaC2 bij deze temperatuur overgaat van vloeistof naar gas. Het kookpunt wordt beïnvloed door intermoleculaire krachten en atmosferische druk. CaC2 heeft sterke ionische bindingen die veel energie vergen om te breken.
Calciumcarbide Smeltpunt
Het smeltpunt van CaC2 is 2160°C. Dit betekent dat CaC2 bij deze temperatuur van vast naar vloeibaar verandert. Het smeltpunt wordt ook beïnvloed door intermoleculaire krachten en atmosferische druk. CaC2 heeft een hoog smeltpunt vanwege de sterke ionische bindingen.
Dichtheid van calciumcarbide g/ml
De dichtheid van CaC2 is 2,22 g/ml. Dit betekent dat één milliliter CaC2 een massa heeft van 2,22 gram. De dichtheid wordt berekend door de massa te delen door het volume. De dichtheid hangt af van de configuratie en rangschikking van atomen of moleculen in de substantie. CaC2 heeft een hoge dichtheid omdat de atomen dicht bij elkaar zijn gepakt in een kristalstructuur.
Moleculair gewicht van calciumcarbide
Het molecuulgewicht van CaC2 is 64.099 amu (atomaire massa-eenheden). Dit betekent dat een CaC2-molecuul een massa heeft van 64.099 amu. Het molecuulgewicht wordt berekend door de atoommassa’s van de elementen in de formule te vermenigvuldigen met hun respectievelijke aantal atomen. De atoommassa van calcium is 40,078 amu en die van koolstof is 12,011 amu.
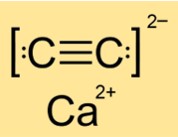
Structuur van calciumcarbide
De structuur van CaC2 is tetragonaal, monoklien of monoklien, afhankelijk van de fase (I, II of III). Dit betekent dat CaC2 verschillende vormen en rangschikkingen van zijn atomen of moleculen heeft in verschillende toestanden of omstandigheden. De structuur wordt bepaald door de symmetrie en geometrie van de substantie. CaC2 heeft een tetragonale structuur in fase I, een monokliene structuur in fase II en een andere monokliene structuur in fase III.
Oplosbaarheid van calciumcarbide
De oplosbaarheid van CaC2 is snelle hydrolyse in water. Dit betekent dat CaC2 snel reageert met water en acetyleengas en calciumhydroxide als producten vormt. Oplosbaarheid wordt gemeten door de hoeveelheid stof die bij een bepaalde temperatuur en druk in een bepaald oplosmiddel kan oplossen. De oplosbaarheid hangt af van de aard en polariteit van de stof en het oplosmiddel, evenals van andere factoren zoals pH en zoutgehalte.
| Verschijning | Wit poeder met grijs/zwarte kristallen of kleurloze kristallijne vaste stof 3 |
| Specifieke dichtheid | 2.22 |
| Kleur | Kleurloos (puur) of grijs/bruin (technische kwaliteit) |
| Geur | Geurloos (puur) of knoflookachtig (technische kwaliteit) |
| Molaire massa | 64.099 g/mol |
| Dikte | 2,22 g/cm3 |
| Fusie punt | 2160°C |
| Kookpunt | 2300°C |
| Flitspunt | 305°C (acetyleen) |
| oplosbaarheid in water | Snelle hydrolyse |
| Oplosbaarheid | Onoplosbaar in ethanol en ether |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | 2,21 (acetyleen) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van calciumcarbide
CaC2 is een brandbare en gevaarlijke chemische stof. Het kan brand- en explosiegevaar veroorzaken als het in contact komt met water of vocht. Er komt acetyleengas vrij, dat ook brandbaar en explosief is. CaC2 kan ook uw gezondheid schaden. Dit kan de huid, ogen en longen irriteren. Dit kan huiduitslag, oogbeschadiging, hoesten en kortademigheid veroorzaken. Het kan er ook voor zorgen dat er zich vocht in uw longen ophoopt als u een grote hoeveelheid inademt. U moet contact met CaC2 vermijden en beschermende uitrusting dragen wanneer u ermee werkt. Bewaar het ook in een droge, gesloten container, uit de buurt van ontstekingsbronnen.
| Gevarensymbolen | F (licht ontvlambaar), C (bijtend), W (reageert met water) |
| Beveiligingsbeschrijving | S2 (buiten bereik van kinderen bewaren), S7/8 (container goed gesloten en droog bewaren), S16 (verwijderd houden van ontstekingsbronnen), S26 (bij contact met de ogen onmiddellijk met veel water afspoelen en een arts raadplegen advies), S36/37/39 (draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming), S43 (in geval van brand, gebruik droog zand of droog chemisch poeder), S45 (in geval van een ongeval of ongemak, zoek onmiddellijk medisch advies) |
| VN-identificatienummers | VN 1402 |
| HS-code | 28491000 |
| Gevarenklasse | 4.3 |
| Verpakkingsgroep | I |
| Toxiciteit | Orale LD50 rat: 80 mg/kg, LC50 inhalatie rat: 1000 ppm/4u |
Synthesemethoden voor calciumcarbide
Er zijn verschillende methoden voor het synthetiseren van CaC2 uit calcium- en koolstofoxidebronnen.
Een van de meest gebruikelijke methoden is de elektrische boogovenmethode. Bij dit proces verwarmt een elektrische boog een mengsel van kalk en cokes tot ongeveer 2.200 °C. De reactie is endotherm en produceert gesmolten CaC2 en koolmonoxide. Na het smelten koelt de CaC2 af en vermalen mensen het tot stukjes of poeder, afhankelijk van het beoogde gebruik. Deze methode heeft een hoog energieverbruik en hoge apparatuurkosten.
Een andere methode is de solid state-methode. Om deze methode uit te voeren, verwarmt u een mengsel van calciumoxide en biochar of uit biomassa afkomstige houtskool in een oven tot ongeveer 1.750 °C. De reactie is vast-vast en produceert vast CaC2 en koolmonoxide. U kunt de vaste stof CaC2 direct gebruiken of verder verwerken. Deze methode heeft een lager energieverbruik en lagere apparatuurkosten dan de vlamboogovenmethode.
Een derde methode is de steenkoolcokes-stroomkwaliteitsubstitutiemethode. Om het proces uit te voeren worden laagwaardige steenkool en kalk gemengd, worden pellets gevormd en vervolgens gepyrolyseerd in een oven op 1000°C. Het geproduceerde gas wekt elektriciteit op en de hete pellets worden overgebracht naar een CaC2-oven van 2000°C. De reactie is vast-vast en produceert gesmolten CaC2 en koolmonoxide. Na afkoelen wordt het gesmolten CaC2 vermalen tot klonten of poeder. Deze methode heeft een hogere energie-efficiëntie en een hoger gebruik van hulpbronnen dan de vlamboogovenmethode.
Gebruik van calciumcarbide
- Wanneer CaC2 reageert met water, produceert het acetyleengas en calciumhydroxide. Acetyleengas is een belangrijk tussenproduct voor de synthese van veel organische chemicaliën en polymeren, zoals polyvinylchloride, vinylacetaat, 1,4-butaandiol, enz. Calciumhydroxide is een veelzijdige verbinding met meerdere toepassingen.
- Om calciumcyanamide te produceren, reageren mensen CaC2 met stikstof bij hoge temperaturen. Calciumcyanamide werkt als stikstofmeststof, herbicide en ontbladeringsmiddel.
- Om het zwavelgehalte van ijzer, gietijzer, gietijzer en staal te verlagen, wordt CaC2 gebruikt. Deze chemische verbinding reageert met zwavel en vormt calciumsulfide, waardoor het metaal effectief wordt ontzwaveld. Dit proces verbetert de kwaliteit en taaiheid van staalproducten.
- Carbidelampen gebruiken CaC2 om acetyleengas te produceren dat bij verbranding licht genereert. Deze lampen waren populair in de mijnbouw, speleologie, fiets- en auto-industrie voordat elektrische lampen gemeengoed werden.
- Mensen gebruiken CaC2 als rijpingsmiddel in fruit zoals bananen, mango’s en papaja’s. Er komt ethyleengas vrij, wat het rijpingsproces versnelt en de kleur en zoetheid van het fruit verbetert. Veel landen beschouwen de praktijk van het gebruik van CaC2-residuen om fruit te laten rijpen als illegaal en schadelijk vanwege de gezondheidsrisico’s die eraan verbonden zijn.
- Mensen gebruiken CaC2 in bamboekanonnen en oerknalkanonnen om harde geluiden te maken. Wanneer het met water wordt gemengd, ontstaat er acetyleengas dat ontbrandt en voor iedereen een leuke en feestelijke ervaring creëert.
- Wordt ook gebruikt als deoxidatiemiddel bij de staalproductie. Het verwijdert zuurstof uit gesmolten staal en voorkomt de vorming van oxiden die de kwaliteit van staalproducten kunnen aantasten.
Vragen:
Vraag: Waar kan ik lokaal calciumcarbide kopen?
A: Mogelijk kunt u bij u in de buurt kleine hoeveelheden CaC2 vinden bij sommige bouwmarkten of winkels voor lasbenodigdheden. Als u echter grote hoeveelheden CaC2 nodig heeft, kunt u dit het beste rechtstreeks van de fabrikant importeren. Met sommige leveranciers kunt u online contact opnemen.
Vraag: Hoe calciumcarbide verwijderen?
A: CaC2 is gevaarlijk afval en moet op de juiste manier worden afgevoerd. Gooi het niet in de prullenbak of in de afvoer, omdat het kan reageren met water en acetyleengas kan produceren, dat brandbaar en explosief is. U dient contact op te nemen met uw plaatselijke autoriteit voor gevaarlijk afval of een erkend afvalverwerkingsbedrijf voor advies over hoe u CaC2 veilig kunt verwijderen. Mogelijk moet het in een goed geventileerde ruimte met water worden geneutraliseerd en vervolgens voor transport in een afgesloten container worden verpakt.
Vraag: Wat ontstaat er als calciumcarbide reageert met zwaar water?
A: Zwaar water is water dat deuterium bevat in plaats van waterstof. Deuterium is een isotoop van waterstof met één proton en één neutron in de kern. Wanneer CaC2 reageert met zwaar water, vormt het calciumhydroxide en gedeutereerd acetyleen. Gedeutereerd acetyleen is acetyleen dat deuterium bevat in plaats van waterstof. De chemische vergelijking voor deze reactie is:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
Vraag: Is calciumcarbide gevaarlijk?
A: Ja, CaC2 is gevaarlijk en er moet met zorg mee worden omgegaan. Het kan brand- en explosiegevaar veroorzaken als het in contact komt met water of vocht, omdat er acetyleengas vrijkomt, dat ook ontvlambaar en explosief is. Het kan ook uw gezondheid schaden, omdat het uw huid, ogen en longen kan irriteren. CaC2 kan huiduitslag, oogbeschadiging, hoesten en kortademigheid veroorzaken. Het kan er ook voor zorgen dat er zich vocht in uw longen ophoopt als u een grote hoeveelheid inademt. U moet contact met CaC2 vermijden en beschermende uitrusting dragen wanneer u ermee werkt. Bewaar het ook in een droge, gesloten container, uit de buurt van ontstekingsbronnen.
Vraag: Is calciumcarbide ionisch of covalent?
A: CaC2 is een ionische verbinding. Het bestaat uit calciumionen (Ca2+) en carbide-ionen (C22-). Ionische verbindingen ontstaan wanneer metaalatomen elektronen verliezen en niet-metaalatomen elektronen winnen om stabiele elektronische configuraties te bereiken. De resulterende ionen worden bij elkaar gehouden door elektrostatische aantrekkingskrachten. CaC2 heeft sterke ionische bindingen die veel energie vergen om te breken.
Vraag: Hoe wordt calciumcarbide gemaakt?
A: CaC2 wordt verkregen door een mengsel van kalk (calciumoxide) en cokes (koolstof) in een vlamboogoven te verwarmen tot ongeveer 2200°C. De reactie is endotherm en produceert gesmolten CaC2 en koolmonoxide. Het gesmolten CaC2 wordt vervolgens afgekoeld en vermalen tot stukjes of poeder. Deze methode heeft een hoog energieverbruik en hoge apparatuurkosten. Er zijn ook andere methoden die verschillende koolstofbronnen gebruiken, zoals biochar of steenkool van lage kwaliteit, en verschillende verwarmingsmethoden, zoals verwarming in vaste toestand of inductieverwarming. Deze methoden kunnen een lager energieverbruik en lagere apparatuurkosten met zich meebrengen dan de vlamboogovenmethode.
Vraag: Kan ik calciumcarbonaat in calciumcarbide veranderen?
A: Nee, je kunt calciumcarbonaat niet direct omzetten in CaC2. Calciumcarbonaat is een stabiele verbinding die bij hoge temperaturen niet reageert met koolstof. Calciumcarbonaat moet eerst worden omgezet in calciumoxide door het sterk te verwarmen in afwezigheid van lucht (calcineren). Vervolgens kun je calciumoxide bij hoge temperaturen laten reageren met koolstof om CaC2 te produceren (carbonisatie). De algemene chemische vergelijking voor dit proces is:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
Vraag: Wat is waar voor de volgende reactie? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
A: De volgende uitspraken zijn waar voor de reactie:
- Het is een synthetische reactie waarbij twee of meer elementen samen een verbinding vormen.
- Dit is een exotherme reactie, waarbij warmte vrijkomt in de omgeving.
- Dit is een redoxreactie, waarbij calcium wordt geoxideerd en koolstof wordt gereduceerd.
- Dit is de omgekeerde reactie van de vorming van CaC2 uit calciumoxide en koolstof.
Vraag: Wat is de standaard vormingswarmte van cac2(s)?
A: De standaard vormingswarmte van cac2(s) is de enthalpieverandering wanneer één mol CaC2 wordt gevormd uit de elementen in hun standaardtoestanden bij 25°C en 1 atm. Het kan worden berekend op basis van de gegeven thermochemische vergelijkingen met behulp van de wet van Hess. De algemene vergelijking voor de vorming van CaC2 is:
Ca(s) + 2C(s) -> CaC2(s)
Met behulp van de wet van Hess kunnen we schrijven:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Daarom is de standaard vormingswarmte van cac2(s) -680,10 kJ/mol.
Vraag: Hoeveel gram cac2 zou nodig zijn om 0,35 mol hcch(g) te genereren?
A: Om deze vraag te beantwoorden, moeten we de gebalanceerde vergelijking gebruiken voor de reactie tussen CaC2 en water:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Uit deze vergelijking kunnen we zien dat één mol cac2 één mol hcch produceert (ook wel acetyleen genoemd). Om 0,35 mol hcch te genereren, hebben we dus 0,35 mol cac2 nodig. Om van mol naar gram om te rekenen, moeten we de molaire massa van cac2 gebruiken, die 64,099 g/mol is. Door het aantal mol te vermenigvuldigen met de molmassa verkrijgen we:
0,35 mol x 64,099 g/mol = 22,435 g
Daarom hebben we 22,435 gram cac2 nodig om 0,35 mol hcch te genereren.
Vraag: Hoeveel mol cac2 zijn nodig om volledig te reageren met 49,0 g water?
A: Om deze vraag te beantwoorden, moeten we de gebalanceerde vergelijking gebruiken voor de reactie tussen calciumcarbide en water:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Uit deze vergelijking kunnen we zien dat één mol cac2 reageert met twee mol water. Om het benodigde aantal mol cac2 te vinden, moeten we daarom het aantal mol water door twee delen. Om grammen naar mol om te rekenen, moeten we de molaire massa van water gebruiken, namelijk 18,015 g/mol. Door de grammen te delen door de molaire massa krijgen we:
49,0 g / 18,015 g/mol = 2,72 mol
Als je dit door twee deelt, krijg je:
2,72 mol / 2 = 1,36 mol
Daarom hebben we 1,36 mol cac2 nodig om volledig te reageren met 49,0 g water.
Vraag: Wat zijn de producten van de reactie tussen calciumcarbide en water?
A: De producten van de reactie tussen CaC2 en water zijn acetyleengas en calciumhydroxideoplossing.
