Calciumbicarbonaat (Ca(HCO3)2) is een verbinding die calcium, koolstof en zuurstof bevat. Het wordt vaak aangetroffen in mineraalwater en is belangrijk voor de gezondheid van de botten en de spierfunctie.
| IUPAC-naam | Calciumwaterstofcarbonaat |
| Moleculaire formule | Ca(HCO3)2 |
| CAS-nummer | 3983-19-5 |
| Synoniemen | Calciumwaterstofcarbonaat, calciumwaterstofcarbonaat, gehydrateerd calciumbicarbonaat, gehydrateerd calciumwaterstofcarbonaat, EINECS 223-070-3 |
| InChi | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Eigenschappen van calciumbicarbonaat
Calciumbicarbonaatformule
De chemische formule voor calciumbicarbonaat is Ca(HCO3)2. Dit geeft aan dat de verbinding bestaat uit één Ca2+-ion en twee HCO3–ionen. De formule is belangrijk voor het begrijpen van de samenstelling van de verbinding en de chemische eigenschappen ervan. Ca(HCO3)2 kan worden gevormd door calciumcarbonaat op te lossen in koolzuurhoudend water of door calciumhydroxide te laten reageren met kooldioxide.
Molaire massa calciumbicarbonaat
De molaire massa van Ca(HCO3)2 bedraagt 162,114 g/mol. Dit wordt berekend door de atoommassa’s van elk element in de verbinding op te tellen. Ca(HCO3)2 bevat calcium-, waterstof-, koolstof- en zuurstofatomen, en de molaire massa weerspiegelt de gecombineerde massa van al deze atomen. Het kennen van de molaire massa is belangrijk voor het bepalen van de hoeveelheid Ca(HCO3)2 die nodig is voor chemische reacties of voor het bepalen van de concentratie van een oplossing.
Kookpunt van calciumbicarbonaat
Ca(HCO3)2 ontleedt voordat het zijn kookpunt bereikt. Bij normale atmosferische druk valt Ca(HCO3)2 uiteen in calciumcarbonaat, water en kooldioxide bij temperaturen boven 50°C. Het heeft dus geen kookpunt.
Smeltpunt van calciumbicarbonaat
Ca(HCO3)2 heeft geen duidelijk smeltpunt omdat het ontleedt voordat het zijn smeltpunt bereikt. Het ontleedt in calciumcarbonaat, water en kooldioxide bij temperaturen boven 50°C. Thermische ontleding van Ca(HCO3)2 kan echter worden gebruikt om calciumoxide te produceren, dat een hoog smeltpunt van 2613°C heeft.
Dichtheid van calciumbicarbonaat g/ml
De dichtheid van Ca(HCO3)2 bedraagt 2,21 g/ml. Dit betekent dat één kubieke centimeter Ca(HCO3)2 2,21 gram weegt. De dichtheid van Ca(HCO3)2 is lager dan de dichtheid van calciumcarbonaat, namelijk 2,71 g/ml. De dichtheid van een stof is belangrijk bij het bepalen van de massa van een stof per volume-eenheid en kan worden gebruikt om de concentratie van een oplossing te berekenen.
Calciumbicarbonaat Molecuulgewicht
Het molecuulgewicht van Ca(HCO3)2 is 162,114 g/mol. Deze waarde wordt berekend door de atoomgewichten van calcium, waterstof, koolstof en zuurstof in de verbinding op te tellen. Het molecuulgewicht is belangrijk bij het bepalen van de hoeveelheid Ca(HCO3)2 die nodig is voor chemische reacties en bij het bepalen van de concentratie van een oplossing.
Structuur van calciumbicarbonaat
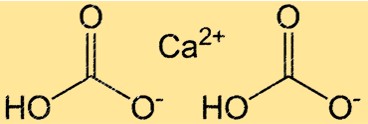
Ca(HCO3)2 heeft een complexe structuur vanwege de aanwezigheid van ionische en covalente bindingen. De verbinding bestaat uit één Ca2+-ion en twee HCO3–ionen, bij elkaar gehouden door ionische bindingen. Het HCO3-ion zelf is een polyatomisch ion bestaande uit één koolstofatoom, twee zuurstofatomen en één waterstofatoom. Het koolstofatoom is dubbel gebonden aan het ene zuurstofatoom en enkelvoudig gebonden aan het andere, en het waterstofatoom is gebonden aan een van de zuurstofatomen. De structuur van Ca(HCO3)2 is belangrijk voor het begrijpen van de reactiviteit en oplosbaarheid ervan in water.
| Verschijning | wit poeder |
| Soortelijk gewicht | 2,21 g/cm³ |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 162.114 g/mol |
| Dikte | 2,21 g/ml |
| Fusie punt | Ontleedt boven 50°C |
| Kookpunt | Ontleedt boven 50°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, onoplosbaar in alcohol |
| Dampdruk | Verwaarloosbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 6,4 – 10,3 |
| pH | 8.2 – 8.4 |
Veiligheid en gevaren van calciumbicarbonaat
Ca(HCO3)2 wordt door regelgevende instanties over het algemeen als veilig beschouwd voor gebruik in voedingsmiddelen en dranken. Het inademen van Ca(HCO3)2-stof kan echter irritatie van de luchtwegen veroorzaken. Contact met de ogen kan irritatie of schade aan het hoornvlies veroorzaken. Inslikken van grote hoeveelheden Ca(HCO3)2 kan maag-darmirritatie veroorzaken. Het hanteren van Ca(HCO3)2 kan bij gevoelige personen ook huidirritatie of dermatitis veroorzaken. Het is belangrijk om de juiste hanteringsprocedures te volgen bij het werken met Ca(HCO3)2, zoals het dragen van handschoenen en een veiligheidsbril. Bovendien is het belangrijk om Ca(HCO3)2 op een koele, droge plaats en uit de buurt van onverenigbare stoffen op te slaan.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Niet giftig en veilig |
| VN-identificatienummers | N.v.t |
| HS-code | 2836.50.00 |
| Gevarenklasse | Niet gevaarlijk |
| Verpakkingsgroep | N.v.t |
| Toxiciteit | Niet giftig en veilig |
Methoden voor de synthese van calciumbicarbonaat
Door de reactie van calciumcarbonaat (CaCO3) met kooldioxide (CO2) en water (H2O) ontstaat Ca(HCO3)2. Deze reactie kan van nature voorkomen in bepaalde waterlichamen, waar kooldioxide en calciumcarbonaat aanwezig zijn.
Om Ca(HCO3)2 te produceren, kan koolstofdioxide door een oplossing van calciumhydroxide (Ca(OH)2) worden geleid. Deze reactie vormt calciumcarbonaat , dat vervolgens reageert met een teveel aan kooldioxide om Ca(HCO3)2 te vormen.
Een andere methode om Ca(HCO3)2 te synthetiseren is het laten reageren van calciumchloride (CaCl2) met natriumbicarbonaat (NaHCO3). Bij deze reactie ontstaat naast Ca(HCO3)2 ook natriumchloride (NaCl) en kooldioxide.
Het is belangrijk op te merken dat Ca(HCO3)2 een relatief onstabiele verbinding is en ontleedt tot calciumcarbonaat en kooldioxide in aanwezigheid van hitte of zure omstandigheden. Om ontleding te voorkomen moet Ca(HCO3)2 met zorg worden gehanteerd en opgeslagen.
Gebruik van calciumbicarbonaat
Hier zijn enkele veelvoorkomende toepassingen van Ca(HCO3)2:
- Voedsel en dranken: Gebruikt als voedseladditief bij de productie van bepaalde bakproducten, waarbij agenten en frisdranken achterblijven.
- Waterbehandeling: Wordt gebruikt om de alkaliteit van water te verhogen, wat pijpcorrosie helpt voorkomen en de zuurgraad van zure waterbronnen vermindert.
- Landbouw: Gebruikt als bodemverbetering om het calciumgehalte van de bodem te verhogen, wat de bodemstructuur en plantengroei kan verbeteren.
- Geneesmiddelen: worden in sommige antacidumformuleringen gebruikt als neutraliserend middel om brandend maagzuur en indigestie te helpen verlichten.
- Constructie: Gebruikt als calciumbron bij de productie van bepaalde bouwmaterialen, zoals cement en gips.
- Reiniging: Wordt gebruikt als mild schuurmiddel in sommige schoonmaakproducten, zoals tandpasta en schoonmaakpoeders.
- Cosmetica: Wordt in sommige cosmetische formules gebruikt als buffermiddel om de pH-waarde van het product op peil te houden.
Vragen:
Vraag: Wat is calciumbicarbonaat?
A: Ca(HCO3)2 is een wit kristallijn poeder dat ontstaat wanneer calciumcarbonaat reageert met koolstofdioxide en water.
Vraag: Welke drie stoffen moeten op elkaar inwerken om calciumbicarbonaat te vormen?
A: Calciumcarbonaat, kooldioxide en water moeten een interactie aangaan om Ca(HCO3)2 te vormen.
Vraag: Is calciumbicarbonaat een rijsmiddel?
A: Ja, Ca(HCO3)2 kan bij het bakken worden gebruikt als rijsmiddel om het deeg te helpen rijzen.
Vraag: Kunnen calciumbicarbonaat-oorkristallen ooit oplossen?
A: Ja, Ca(HCO3)2-kristallen in het oor kunnen zelfstandig oplossen of met behandeling, bijvoorbeeld door het gebruik van bepaalde medicijnen of manoeuvres.
Vraag: Wat is het totale aantal mol atomen in één mol Ca(HCO3)2?
A: Er zitten 10 mol atomen in één mol Ca(HCO3)2.
Vraag: Hoeveel atomen zitten er in Ca(HCO3)2?
A: Er zijn in totaal 18 atomen aanwezig in Ca(HCO3)2, waaronder 1 calciumatoom, 2 koolstofatomen, 6 waterstofatomen en 9 zuurstofatomen.
Vraag: Wat is Ca(HCO3)2?
A: Ca(HCO3)2 is de chemische formule voor calciumbicarbonaat, een verbinding die wordt gevormd wanneer calciumcarbonaat reageert met koolstofdioxide en water.
