Calciumacetaat (Ca(C2H3O2)2) is een verbinding bestaande uit calcium en azijnzuur. Het wordt vaak gebruikt als medicijn om het fosfaatgehalte te verlagen bij mensen met een nierziekte.
| IUPAC-naam | Calciumacetaat |
| Moleculaire formule | Ca(C2H3O2)2 |
| CAS-nummer | 62-54-4 |
| Synoniemen | Azijnzuur, calciumzout; Calciumacetaat (Frans); Calciumdiacetaat; Calciumethanoaat; E263 |
| InChi | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschappen van calciumacetaat
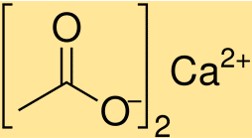
Calciumacetaatformule
De formule voor calciumacetaat is Ca(C2H3O2)2. Deze formule geeft aan dat één mol calciumacetaat één mol calciumionen (Ca2+) en twee mol acetaationen (C2H3O2-) bevat. De formule voor calciumacetaat is essentieel voor het bepalen van de stoichiometrie van chemische reacties waarbij deze verbinding betrokken is.
Molaire massa calciumacetaat
De molaire massa van Ca(C2H3O2)2 bedraagt 158,17 g/mol. Deze waarde vertegenwoordigt de massa van één mol Ca(C2H3O2)2, wat gelijk is aan het molecuulgewicht ervan. Molaire massa is een cruciale parameter bij het bepalen van de stoichiometrie van chemische reacties waarbij Ca(C2H3O2)2 betrokken is. Deze waarde wordt berekend door de atoommassa’s van alle atomen die aanwezig zijn in één mol Ca(C2H3O2)2 bij elkaar op te tellen.
Kookpunt van calciumacetaat
Het kookpunt van Ca(C2H3O2)2 is 160°C (320°F). Deze waarde geeft de temperatuur aan waarbij Ca(C2H3O2)2 van toestand verandert van vloeistof naar gas. Het kookpunt van Ca(C2H3O2)2 is aanzienlijk hoger dan dat van water, dat kookt bij 100°C (212°F). Dit hoge kookpunt is te wijten aan de ionische aard van Ca(C2H3O2)2 en zijn sterke intermoleculaire krachten.
Calciumacetaat Smeltpunt
Het smeltpunt van Ca(C2H3O2)2 is 160-170°C (320-338°F). Deze waarde geeft de temperatuur aan waarbij Ca(C2H3O2)2 van vaste naar vloeibare toestand verandert. Het smeltpunt van Ca(C2H3O2)2 ligt iets hoger dan dat van water, dat smelt bij 0°C (32°F). Het hoge smeltpunt van Ca(C2H3O2)2 is te wijten aan de ionische aard van de verbinding en de sterke intermoleculaire krachten ervan.
Dichtheid van calciumacetaat g/ml
De dichtheid van Ca(C2H3O2)2 bedraagt 1,5 g/ml. Deze waarde geeft de massa Ca(C2H3O2)2 aan die aanwezig is in één milliliter van de oplossing. De dichtheid van Ca(C2H3O2)2 is groter dan die van water, dat een dichtheid heeft van 1 g/ml. De hoge dichtheid van Ca(C2H3O2)2 is te danken aan de ionische aard ervan en de aanwezigheid van calciumionen in de verbinding.
Calciumacetaat Molecuulgewicht
Het molecuulgewicht van Ca(C2H3O2)2 bedraagt 158,17 g/mol. Deze waarde vertegenwoordigt de som van de atoomgewichten van alle atomen die aanwezig zijn in een Ca(C2H3O2)2-molecuul. Het molecuulgewicht is een kritische parameter bij het bepalen van de eigenschappen van Ca(C2H3O2)2 en het gedrag ervan in chemische reacties.
Structuur van calciumacetaat
De structuur van Ca(C2H3O2)2 is een ionische verbinding waarin de Ca2+-ionen omgeven zijn door twee C2H3O2-ionen. C2H3O2-ionen fungeren als tweetandige liganden en vormen coördinatiebindingen met Ca2+-ionen. De structuur van Ca(C2H3O2)2 is kristallijn en heeft een kubusvorm.
| Verschijning | Wit kristallijn poeder |
| Soortelijk gewicht | 1,5 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 158,17 g/mol |
| Dikte | 1,5 g/ml |
| Fusie punt | 160-170°C (320-338°F) |
| Kookpunt | 160°C (320°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in water, ethanol en aceton |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 9.24 |
| pH | 7-8 (5% oplossing) |
Veiligheid en gevaren van calciumacetaat
Ca(C2H3O2)2 wordt over het algemeen als veilig beschouwd als het volgens de aanwijzingen wordt gebruikt. Blootstelling aan grote hoeveelheden Ca(C2H3O2)2 kan echter de huid, ogen en luchtwegen irriteren. Het innemen van grote hoeveelheden Ca(C2H3O2)2 kan maagklachten, braken en diarree veroorzaken. Het is belangrijk om voorzichtig om te gaan met Ca(C2H3O2)2 en het inademen of inslikken van de stof te vermijden. Ca(C2H3O2)2 kan ook een risico vormen voor het milieu, met name voor het waterleven, en moet op de juiste manier worden verwijderd. Zoals bij alle chemicaliën is het belangrijk om de veiligheidsinstructies op het etiket te lezen en op te volgen en geschikte beschermende uitrusting te gebruiken bij het hanteren van Ca(C2H3O2)2.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | Vermijd inademing, inslikken en contact met huid en ogen. Gebruik in een goed geventileerde ruimte en draag geschikte beschermende uitrusting. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 291529 |
| Gevarenklasse | Niet geclassificeerd als gevaarlijk volgens OSHA Hazard Communication (29 CFR 1910.1200). |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage toxiciteit. Kan huid- en oogirritatie veroorzaken. Inslikken van grote hoeveelheden kan maag-darmklachten veroorzaken. |
Methoden voor de synthese van calciumacetaat
Er kunnen verschillende methoden worden gebruikt om Ca(C2H3O2)2 te synthetiseren.
Een gebruikelijke methode omvat de reactie van calciumcarbonaat met azijnzuur. Voeg het calciumcarbonaat toe aan een azijnzuuroplossing en verwarm het mengsel tot reflux. Filtreer het mengsel en laat het filtraat afkoelen en kristalliseren onder vorming van Ca(C2H3O2)2.
Een andere methode omvat de reactie van calciumhydroxide met azijnzuur . Voeg calciumhydroxide toe aan de azijnzuuroplossing. Roer en verwarm het mengsel om een heldere oplossing te verkrijgen. Filtreer de oplossing en laat het filtraat afkoelen en kristalliseren om Ca(C2H3O2)2 te vormen.
Een andere methode omvat de reactie van calciumoxide met azijnzuur . Voeg calciumoxide toe aan de azijnzuuroplossing. Roer en verwarm het mengsel om een heldere oplossing te verkrijgen. Filtreer de oplossing en laat het filtraat afkoelen en kristalliseren om Ca(C2H3O2)2 te vormen.
De keuze voor de synthesemethode kan afhankelijk zijn van factoren als de gewenste opbrengst en zuiverheid van het product, maar ook van de specifieke toepassing waarvoor de Ca(C2H3O2)2 gebruikt zal worden.
Gebruik van calciumacetaat
Ca(C2H3O2)2 kent diverse toepassingen op diverse terreinen. Hier zijn enkele veelvoorkomende toepassingen van Ca(C2H3O2)2:
- Voedseladditief: Gebruikt als voedseladditief, vooral in gebakken goederen, om de textuur te verbeteren en de houdbaarheid te verlengen.
- Medicinale toepassingen: Gebruikt als medicijn voor de behandeling van hoge fosfaatwaarden in het bloed bij patiënten met chronische nierziekte. Het werkt door zich te binden aan fosfaat dat in voedsel wordt aangetroffen en de opname ervan door het lichaam te voorkomen.
- Waterbehandeling: Gebruikt bij waterbehandeling om het loodgehalte en andere zware metalen te verminderen.
- Laboratoriumreagens: Gebruikt als reagens in laboratoria voor verschillende chemische reacties.
- Antischimmelmiddel: Wordt ook gebruikt als antischimmelmiddel bij de behandeling van bepaalde huidinfecties.
- Betonversneller: Gebruikt als betonversneller, die het betonuithardingsproces helpt versnellen.
- Vlamvertrager: Gebruikt als vlamvertrager in verschillende materialen, waaronder kunststoffen en textiel.
Vragen:
Vraag: Is calciumacetaat zuur, basisch of neutraal?
A: Ca(C2H3O2)2 is een basische verbinding.
Vraag: Is calciumacetaat oplosbaar in water?
A: Ja, Ca(C2H3O2)2 is oplosbaar in water.
Vraag: Hoe maak je calciumacetaat?
A: Ca(C2H3O2)2 kan op verschillende manieren worden gemaakt, waaronder de reactie van calciumcarbonaat of calciumhydroxide met azijnzuur. Het resulterende mengsel wordt vervolgens gefiltreerd en het filtraat mag afkoelen en kristalliseren, waarbij Ca(C2H3O2)2 wordt gevormd.
Vraag: Waar kan ik calciumacetaat kopen?
A: Ca(C2H3O2)2 kan worden gekocht bij chemische leveranciers, laboratoriumwinkels en online retailers.
Vraag: Is calciumacetaat ionisch of covalent?
A: Ca(C2H3O2)2 is een ionische verbinding die bestaat uit calciumkationen en acetaatanionen die bij elkaar worden gehouden door ionische bindingen.
