Benzeen of C6H6 is een kleurloze, licht ontvlambare vloeistof met een zoete geur. Het wordt gebruikt bij de productie van kunststoffen, synthetische vezels, rubber, pesticiden en andere chemicaliën. Het is een bekend kankerverwekkende stof en kan gezondheidsproblemen veroorzaken.
| Naam van IUPAC | Benzeen |
| Moleculaire formule | C6H6 |
| CAS-nummer | 71-43-2 |
| Synoniemen | Benzol, feen, annuleen, cyclohexatrieen, enz. |
| InChi | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Eigenschappen van benzeen
Molaire massa van benzeen
Benzeen heeft een molaire massa van 78,11 g/mol. Het is een cyclische organische verbinding bestaande uit zes koolstofatomen en zes waterstofatomen. De molaire massa van benzeen wordt berekend door de atoommassa’s van de samenstellende atomen op te tellen, namelijk 12,01 g/mol voor koolstof en 1,01 g/mol voor waterstof. Benzeen wordt in de chemische industrie veel gebruikt als grondstof voor de productie van veel belangrijke verbindingen. De molmassa van benzeen is belangrijk bij het bepalen van de hoeveelheid verbinding die nodig is voor reacties en andere toepassingen.
Benzeen formule
Benzeen heeft de chemische formule C6H6. Deze formule vertegenwoordigt het aantal en het type atomen dat in het molecuul aanwezig is. De formule van benzeen is belangrijk bij het bepalen van de fysische en chemische eigenschappen ervan, evenals de reactiviteit ervan bij chemische reacties. De benzeenformule wordt ook gebruikt om de verbinding in verschillende contexten een naam te geven en te identificeren, zoals in chemische literatuur en regelgevingsdocumenten.
Kookpunt van benzeen
Benzeen heeft een kookpunt van 80,1°C of 176,2°F. Dit is relatief laag vergeleken met andere organische verbindingen met een vergelijkbaar molecuulgewicht. Het kookpunt van C6H6 is te wijten aan de intermoleculaire aantrekkingskrachten, met name de Van der Waals-krachten. Naarmate de temperatuur stijgt, neemt ook de kinetische energie van de moleculen toe, wat uiteindelijk leidt tot de afbraak van deze intermoleculaire krachten en de overgang van de vloeibare naar de gasfase. Het lage kookpunt van C6H6 maakt het bruikbaar in toepassingen waarbij het nodig is de verbinding door verdamping te verwijderen.
Smeltpunt van benzeen
C6H6 heeft een smeltpunt van 5,5°C of 41,9°F. Dit is relatief laag vergeleken met andere aromatische verbindingen met een vergelijkbaar molecuulgewicht. Het smeltpunt van C6H6 is te danken aan de moleculaire structuur, die bestaat uit een vlakke ring van koolstofatomen met afwisselende dubbele bindingen. De rangschikking van elektronen in de ring geeft C6H6 zijn karakteristieke stabiliteit en maakt het bestand tegen vele chemische reacties. Het lage smeltpunt van C6H6 maakt het bruikbaar in toepassingen waarbij het nodig is om de verbinding te smelten voor verdere verwerking.
Benzeendichtheid g/ml
Benzeen heeft een dichtheid van 0,879 g/ml bij kamertemperatuur (25°C of 77°F). Benzeendichtheid is een maat voor de massa per volume-eenheid van de verbinding. De lage dichtheid van benzeen maakt het bruikbaar in toepassingen waarbij een oplosmiddel met lage dichtheid vereist is, zoals bij de scheiding van verbindingen op basis van hun dichtheid.
Molecuulgewicht van benzeen
Benzeen heeft een molecuulgewicht van 78,11 g/mol. Het molecuulgewicht van benzeen is de som van de atoomgewichten van de samenstellende atomen. Het molecuulgewicht van benzeen is belangrijk bij het bepalen van de stoichiometrie van reacties en bij het bepalen van de concentratie van benzeen in oplossingen.
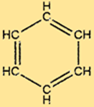
Structuur van benzeen
C6H6 heeft een unieke structuur die bestaat uit een zeshoekige ring van koolstofatomen, elk gebonden aan twee andere koolstofatomen en één waterstofatoom. Afwisselende dubbele bindingen in de ring geven C6H6 zijn karakteristieke stabiliteit en maken het bestand tegen vele chemische reacties. De structuur van C6H6 maakt het ook tot een bruikbare grondstof voor de productie van veel belangrijke verbindingen.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,879 g/ml |
| Kleur | Kleurloos |
| Geur | Zacht |
| Molaire massa | 78,11 g/mol |
| Dikte | 0,879 g/ml |
| Fusie punt | 5,5°C (41,9°F) |
| Kookpunt | 80,1°C (176,2°F) |
| Flitspunt | -11°C (12,2°F) |
| oplosbaarheid in water | 1,79 g/l |
| Oplosbaarheid | Onoplosbaar in water, oplosbaar in organische oplosmiddelen |
| Dampdruk | 12,1 kPa bij 20°C |
| Dampdichtheid | 2,8 (lucht=1) |
| pKa | 43.2 |
| pH | Neutrale |
Benzeenveiligheid en gevaren
C6H6 is een licht ontvlambare en giftige stof die aanzienlijke risico’s voor de menselijke gezondheid en het milieu met zich meebrengt. Het is een bekend carcinogeen en kan bij mensen leukemie, aplastische anemie en andere bloedaandoeningen veroorzaken. Blootstelling aan C6H6 kan plaatsvinden door inademing, huidcontact of inslikken en kan leiden tot acute en chronische gevolgen voor de gezondheid. Het is belangrijk om C6H6 te hanteren met passende veiligheidsmaatregelen, waaronder voldoende ventilatie, beschermende kleding en ademhalingsbescherming. C6H6 moet ook worden opgeslagen en afgevoerd in overeenstemming met de plaatselijke regelgeving om milieuverontreiniging en risico’s voor de volksgezondheid tot een minimum te beperken.
| Gevarensymbolen | Schedel en gekruiste knekels, vlam |
| Beveiligingsbeschrijving | Licht ontvlambaar, giftig, kankerverwekkend, schadelijk bij inslikken, irriterend |
| AN-identificaties | UN 1114 (Benzeen), UN 1992 (Ontvlambare, giftige vloeistoffen) |
| HS-code | 2902.20.00 |
| Gevarenklasse | 3 (Ontvlambare vloeistoffen), 6.1 (Giftige stoffen), 8 (Bijtende stoffen) |
| Verpakkingsgroep | II (Benzeen), III (Ontvlambare, giftige vloeistoffen) |
| Toxiciteit | Acute toxiciteit: Zeer giftig (LD50: 2,5 g/kg oraal, 0,44 mg/L bij inademing), Chronische toxiciteit: Kankerverwekkend, Mutageen, Giftigheid voor de voortplanting |
Benzeensynthesemethoden
Er zijn verschillende methoden voor het synthetiseren van benzeen, een belangrijke industriële chemische stof die wordt gebruikt bij de productie van kunststoffen, rubber en farmaceutische producten.
Een gebruikelijke methode is het katalytisch reformeren van petroleumnafta, waarbij nafta in aanwezigheid van een katalysator, zoals platina of renium, tot hoge temperaturen wordt verwarmd om een mengsel van aromatische koolwaterstoffen, waaronder benzeen, te produceren.
Een andere methode is de hydrodealkylering van tolueen, waarbij tolueen met waterstof wordt omgezet in aanwezigheid van een katalysator, zoals chroomoxide of molybdeenoxide, om de methylgroep te verwijderen en benzeen te vormen.
Pyrolyse van koolwaterstoffen, zoals steenkool of aardolie, bij hoge temperaturen in afwezigheid van zuurstof synthetiseert benzeen. Dit proces resulteert in de vorming van een mengsel van aromatische koolwaterstoffen, waaronder benzeen.
Andere methoden voor het synthetiseren van benzeen omvatten de reactie van acetyleen met zichzelf in aanwezigheid van een katalysator, zoals koper, om benzeen te vormen, evenals de reactie van fenol met formaldehyde in aanwezigheid van een zure katalysator, zoals zwavelzuur, om benzeen vormen. benzeen produceren.
Elk van deze methoden heeft zijn eigen voor- en nadelen, afhankelijk van factoren zoals kosten, effectiviteit en impact op het milieu. De keuze van de benzeensynthesemethode zal afhangen van de specifieke toepassings- en productieprocesvereisten.
Gebruik van benzeen
Benzeen is een veelzijdige en belangrijke industriële chemische stof met een breed scala aan toepassingen in verschillende industrieën. Enkele van de belangrijkste toepassingen van benzeen zijn:
- Kunststofproductie: gebruikt bij de productie van verschillende soorten kunststoffen, waaronder polystyreen, polyurethaan en nylon.
- Rubberproductie: Producenten van synthetisch rubber gebruiken het bij hun productie. Fabrikanten gebruiken dit synthetische rubber vervolgens om banden, pijpen, riemen en andere rubberproducten te maken.
- Farmaceutische productie: Gebruikt als grondstof voor de productie van diverse farmaceutische producten, waaronder antibiotica, antihistaminica en pijnstillers.
- Oplosmiddel: Wordt gebruikt als oplosmiddel voor een breed scala aan organische verbindingen, waaronder vetten, oliën, harsen en wassen.
- Brandstof: Gebruikt als brandstofadditief met een hoog octaangehalte, waardoor de prestaties van benzinemotoren worden verbeterd.
- Olie-extractie: Gebruikt bij de extractie van oliën, zoals plantaardige oliën en essentiële oliën, uit planten.
- Kleefstoffen: Gebruikt bij de productie van lijmen, zoals rubbercement en contactcement.
- Kleurstoffen: Gebruikt bij de productie van verschillende soorten kleurstoffen, waaronder synthetische kleurstoffen die in de textielindustrie worden gebruikt.
Vragen:
Vraag: Is benzeen polair?
A: Nee, benzeen is een niet-polair molecuul omdat het een symmetrische structuur heeft en de polariteiten van de individuele bindingen elkaar opheffen.
Vraag: Waar wordt benzeen voor gebruikt?
A: Benzeen wordt gebruikt bij de productie van verschillende materialen, waaronder kunststoffen, rubber, farmaceutische producten, oplosmiddelen, brandstofadditieven, lijmen en kleurstoffen.
Vraag: Welke verbinding geleidt elektriciteit als deze in water wordt opgelost? CH4, CuSO4, C6H6 of C6H12O6?
A: CuSO4 geleidt elektriciteit wanneer het in water wordt opgelost, omdat het zich dissocieert in ionen, waardoor er elektrische stroom kan stromen.
Vraag: Is C6H6 polair of niet-polair?
A: C6H6, ook bekend als benzeen, is een niet-polair molecuul omdat het een symmetrische structuur heeft en de polariteiten van de individuele bindingen elkaar opheffen.
Vraag: Is C6H6 oplosbaar in water?
A: Nee, C6H6 is niet oplosbaar in water omdat het een niet-polair molecuul is en geen goede interactie heeft met polaire oplosmiddelen zoals water.
