Nitrobenzeen of C6H5NO2 is een organische verbinding met een lichtgele kleur en een duidelijke geur. Het wordt gebruikt als voorloper voor de productie van aniline en andere chemicaliën. Het is ook een giftige stof.
| IUPAC-naam | Nitrobenzeen |
| Moleculaire formule | C6H5NO2 |
| CAS-nummer | 98-95-3 |
| Synoniemen | Nitrobenzol, Nitrobenzeen, Mirbane Essence, NB |
| InChi | InChI=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
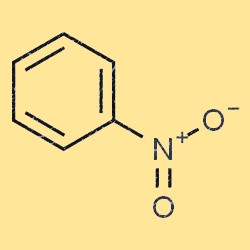
Structuur van nitrobenzeen
Nitrobenzeen heeft een vlakke, vlakke moleculaire structuur. Het bestaat uit een benzeenring (C6H5) met aan een van de koolstofatomen een nitrogroep (-NO2). De nitrogroep is een elektronenzuigende groep, wat betekent dat deze de elektronendichtheid van de benzeenring vermindert. Deze eigenschap maakt nitrobenzeen bij veel chemische reacties minder reactief dan benzeen.
Nitrobenzeen-formule
De chemische formule voor nitrobenzeen is C6H5NO2. Deze formule vertegenwoordigt het aantal en het type atomen waaruit het molecuul bestaat. De benzeenring vormt de ruggengraat van het molecuul, terwijl de nitrogroep een polaire functionele groep vormt die de eigenschappen van de verbinding beïnvloedt. De formule van nitrobenzeen is belangrijk voor het begrijpen van de chemische en fysische eigenschappen ervan, evenals de reactiviteit ervan met andere stoffen.
Molaire massa van nitrobenzeen
De molaire massa van nitrobenzeen, ook wel C6H5NO2 genoemd, is 123,11 g/mol. Dit wordt berekend door de atoommassa’s van alle atomen in de verbinding op te tellen. Nitrobenzeen heeft een relatief hoge molaire massa, vanwege de aanwezigheid van zes koolstofatomen en één stikstofatoom in de chemische structuur.
Kookpunt van nitrobenzeen
Nitrobenzeen heeft een kookpunt van 210,9°C. Dit is relatief hoog vergeleken met andere organische verbindingen met vergelijkbare molecuulgewichten. Het hoge kookpunt is te wijten aan de aanwezigheid van sterke intermoleculaire aantrekkingskrachten tussen nitrobenzeenmoleculen, zoals waterstofbruggen en dipool-dipoolinteracties.
Smeltpunt van nitrobenzeen
Het smeltpunt van nitrobenzeen is 5,85°C. Dit is relatief laag vergeleken met het kookpunt, wat kan worden verklaard door het feit dat de intermoleculaire aantrekkingskrachten in de vaste toestand zwakker zijn dan in de vloeibare toestand. Bovendien kan nitrobenzeen polymorfisme vertonen, wat betekent dat het in meerdere kristalstructuren met verschillende smeltpunten kan voorkomen.
Dichtheid van nitrobenzeen g/ml
De dichtheid van nitrobenzeen is 1,20 g/ml bij kamertemperatuur (25°C). Dit betekent dat nitrobenzeen een hogere dichtheid heeft dan water, dat bij dezelfde temperatuur een dichtheid heeft van 1 g/ml. De dichtheid van nitrobenzeen wordt beïnvloed door het molecuulgewicht en de grootte en vorm van de moleculen.
Molecuulgewicht van nitrobenzeen
Het molecuulgewicht van nitrobenzeen is 123,11 g/mol. Dit wordt berekend door de atoommassa’s van alle atomen in de verbinding op te tellen. Het molecuulgewicht van nitrobenzeen is belangrijk bij het bepalen van de fysische en chemische eigenschappen ervan, zoals kookpunt, smeltpunt en oplosbaarheid.
| Verschijning | Lichtgele vloeistof |
| Soortelijk gewicht | 1,20 g/cm3 |
| Kleur | Bleek geel |
| Geur | Kenmerkend |
| Molaire massa | 123,11 g/mol |
| Dikte | 1,20 g/ml bij 25°C |
| Fusie punt | 5,85°C |
| Kookpunt | 210,9°C |
| Flitspunt | 77°C |
| oplosbaarheid in water | 7,9 g/l bij 25°C |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 0,68 mmHg bij 25°C |
| Dampdichtheid | 4,35 (lucht=1) |
| pKa | -1.15 |
| pH | 7 (neutraal) |
Veiligheid en gevaren van nitrobenzeen
Nitrobenzeen is een zeer giftige stof die verschillende veiligheids- en gezondheidsrisico’s met zich meebrengt. Het kan bij contact of inademing irritatie van de huid, ogen en luchtwegen veroorzaken. Langdurige blootstelling aan nitrobenzeen kan lever- en nierschade, bloedarmoede en methemoglobinemie veroorzaken. Nitrobenzeen is ook zeer brandbaar en kan bij relatief lage temperaturen ontbranden. Bovendien kunnen er giftige dampen vrijkomen bij verhitting, verbranding of ontbinding. Het is daarom essentieel om voorzichtig om te gaan met nitrobenzeen, geschikte beschermende uitrusting te dragen en het op een koele, droge plaats op te slaan, uit de buurt van ontstekingsbronnen en onverenigbare stoffen.
| Gevarensymbolen | T, N |
| Beveiligingsbeschrijving | Zeer giftig, schadelijk bij inslikken, inademen of opname via de huid, veroorzaakt ernstige brandwonden en oogletsel. |
| AN-identificaties | VN1662 |
| HS-code | 2904.90.90 |
| Gevarenklasse | 6.1 |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Nitrobenzeensynthesemethoden
Nitrobenzeen kan op verschillende manieren worden gesynthetiseerd, waaronder nitrering van benzeen, reductie van nitrobenzeen en hydrogenering van nitrobenzeen. De meest gebruikte methode is benzeennitrering, waarbij benzeen reageert met een mengsel van salpeterzuur en zwavelzuur bij een temperatuur van ongeveer 50°C. De nitreringsreactie produceert een mengsel van nitrobenzeen, evenals andere nitroderivaten van benzeen.
Een andere methode om nitrobenzeen te synthetiseren is nitrobenzeenreductie, waarbij gebruik wordt gemaakt van reductiemiddelen zoals ijzer of zink en zoutzuur. De reductiereactie zet de nitrogroep (-NO2) van nitrobenzeen om in een aminogroep (-NH2), waarbij aniline als bijproduct ontstaat.
Hydrogenering van nitrobenzeen is een andere methode voor anilinesynthese. Deze methode omvat het gebruik van een katalysator, zoals nikkel of palladium, en waterstofgas, dat reageert met nitrobenzeen om aniline te produceren.
Gebruik van nitrobenzeen
Nitrobenzeen is een veelzijdige chemische stof die in een breed scala aan toepassingen wordt gebruikt.
- De chemische industrie gebruikt nitrobenzeen als voorloper van aniline, een belangrijk ingrediënt bij de productie van kleurstoffen, rubber en farmaceutische producten. Nitrobenzeen is een waardevolle grondstof voor de productie van andere chemicaliën zoals fenol, dat wordt gebruikt bij de productie van kunststoffen, harsen en lijmen.
- Organische verbindingen zoals oliën, vetten en wassen kunnen worden opgelost met nitrobenzeen, waardoor het een nuttig oplosmiddel is. In de voedingsindustrie wordt nitrobenzeen gebruikt als smaakstof, vooral bij de productie van kauwgom.
- C6H5NO2 is een essentieel onderdeel bij de productie van explosieven zoals TNT (trinitrotolueen). Als brandstofadditief helpt nitrobenzeen het octaangetal van benzine te verhogen.
- C6H5NO2 wordt ook gebruikt bij de productie van verschillende pesticiden en herbiciden, waaronder insecticiden en fungiciden.
- De productie van synthetische vezels zoals nylon is ook afhankelijk van nitrobenzeen als essentieel onderdeel.
Over het geheel genomen maakt de veelzijdige aard van nitrobenzeen het tot een essentiële chemische stof in veel industrieën, waaronder de chemische, voedsel- en textielindustrie. Bij het gebruik van nitrobenzeen zijn echter juiste hantering en veiligheidsmaatregelen noodzakelijk vanwege de toxiciteit en ontvlambaarheid ervan.
Vragen:
Reactie van nitrobenzeen met aniline
De omzetting van nitrobenzeen in aniline is een tweestapsreactie waarbij de nitrogroep (-NO2) wordt gereduceerd tot een aminogroep (-NH2) en de daaropvolgende hydrolyse van het tussenproduct.
De reductie van C6H5NO2 wordt gewoonlijk bereikt met behulp van een reductiemiddel, zoals ijzer of zink, en een zure oplossing, zoals zoutzuur. De reactie produceert een tussenproduct, nitrosobenzeen, dat vervolgens wordt gereduceerd tot aniline in aanwezigheid van een zure of base-katalysator.
Hydrolyse van het nitrosobenzeentussenproduct tot aniline wordt tot stand gebracht door het tussenproduct te behandelen met een zure oplossing, zoals verdund zoutzuur. De reactie produceert aniline, evenals water en stikstofoxide (NO).
De totale reactie kan als volgt worden weergegeven: Nitrobenzeen + 3 H2 → Aniline + 2 H2O + N2
