1-Bromobutaan is een kleurloze vloeibare organische verbinding met de molecuulformule C4H9Br. Het wordt gebruikt als alkyleringsmiddel bij organische synthese en als oplosmiddel in de industrie.
| IUPAC-naam | Butylbromide |
| Moleculaire formule | C4H9Br |
| CAS-nummer | 109-65-9 |
| Synoniemen | 1-broombutaan, n-butylbromide, butylbromide, broombutaan, butaan, 1-broom-, 109-65-9, 1-broombutaan, 1-broombutaan, n-C4H9Br |
| InChi | InChI=1S/C4H9Br/c1-2-3-4-5/h2-4H2.1H3 |
Molaire massa van 1-broombutaan
De molaire massa van 1-broombutaan is 137,03 g/mol. Om de molaire massa van 1-broombutaan te verkrijgen, voegen we de atoommassa’s van koolstof, waterstof en broom toe in één molecuul. Chemische berekeningen vereisen vaak dat de massa van een stof wordt omgezet in het aantal mol, en de molaire massa is essentieel voor deze omzetting.
Dichtheid van 1-broombutaan g/ml
De dichtheid van 1-broombutaan is 1,27 g/ml bij 25°C (77°F). Dit is de massa per volume-eenheid van de stof. De dichtheid van 1-broombutaan is groter dan die van water, waardoor het gemakkelijk kan worden gescheiden van waterige oplossingen.
Kookpunt van 1-broombutaan
Het kookpunt van 1-broombutaan is 101°C (214°F). Het is de temperatuur waarbij de dampdruk van de vloeistof gelijk is aan de externe druk. Het is een maatstaf voor de sterkte van de intermoleculaire krachten in de vloeistof. Het kookpunt van 1-broombutaan maakt het een nuttig oplosmiddel en reagens in de organische chemie.
Smeltpunt van C4H9Br
Het smeltpunt van C4H9Br is -112°C (-170°F). Het is de temperatuur waarbij de vaste en vloeibare fasen van de stof in evenwicht zijn. Het smeltpunt hangt af van de sterkte van de intermoleculaire krachten die in de vaste stof aanwezig zijn. Door het lage smeltpunt van C4H9Br is het bij kamertemperatuur vloeibaar en kan het gemakkelijk worden gehanteerd.
Molecuulgewicht C4H9Br
Het molecuulgewicht van C4H9Br is 137,03 g/mol. Het is de som van de atoomgewichten van alle atomen in het molecuul. Het molecuulgewicht wordt gebruikt om de hoeveelheid van een stof te berekenen die nodig is voor een reactie of om de hoeveelheid verkregen product te bepalen.
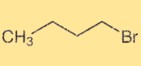
1-broombutaanstructuur
1-Broombutaan heeft een alkylstructuur met rechte keten, waarbij een broomatoom aan het vierde koolstofatoom is bevestigd. Het is een organische verbinding met de chemische formule C4H9Br. De structuur van 1-broombutaan bepaalt de fysische en chemische eigenschappen en de reactiviteit ervan in organische reacties.
Formule 1-Broombutaan
De formule voor 1-broombutaan is C4H9Br. Dit toont het aantal en het type atomen dat in het molecuul aanwezig is. De formule van 1-broombutaan is belangrijk bij het bepalen van de reactiviteit en het gedrag ervan bij chemische reacties.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 1,27 bij 25°C |
| Kleur | Kleurloos |
| Geur | Karakteristieke en zoete geur |
| Molaire massa | 137,03 g/mol |
| Dikte | 1,27 g/ml bij 25°C |
| Fusie punt | -112°C |
| Kookpunt | 101°C |
| Flitspunt | 25°C |
| oplosbaarheid in water | Enigszins oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol, ether, chloroform |
| Dampdruk | 10 mmHg bij 25°C |
| Dampdichtheid | 4.6 |
| pKa | 16.5 |
| pH | Neutrale |
1-Broombutaan Veiligheid en gevaren
1-Bromobutaan is een gevaarlijke chemische stof waarmee voorzichtig moet worden omgegaan. Het is giftig bij inslikken of inademen en kan bij contact huid- en oogirritatie veroorzaken. De chemische stof is ook ontvlambaar en kan brandgevaar opleveren bij blootstelling aan hitte, vonken of vlammen. Het is belangrijk om geschikte beschermende uitrusting te dragen, zoals handschoenen, een veiligheidsbril en een laboratoriumjas, wanneer u met 1-broombutaan werkt. De chemische stof moet worden opgeslagen in een koele, droge, goed geventileerde ruimte en uit de buurt van ontstekingsbronnen worden gehouden. In geval van accidentele blootstelling, het getroffen gebied onmiddellijk met water afspoelen en medische hulp inroepen.
| Gevarensymbolen | T,F |
| Beveiligingsbeschrijving | Uit de buurt houden van hitte, vonken en vlammen. Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. NA INADEMING: Het slachtoffer in de frisse lucht brengen en laten rusten in een houding die het ademen vergemakkelijkt. NA INSLIKKEN: Bij onwel voelen een ANTIGIFCENTRUM of een arts raadplegen. Spoel je mond. Opslaan in een goed geventileerde ruimte. Blijf rustig. Inhoud/verpakking afvoeren in overeenstemming met lokale/regionale/nationale/internationale regelgeving. |
| AN-identificaties | UN1126 |
| HS-code | 290339 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inslikken of inademen. Kan huid- en oogirritatie veroorzaken. |
Methoden voor de synthese van 1-broombutaan
C4H9Br kan worden gesynthetiseerd door de reactie van 1-butanol en broomwaterstofzuur (HBr) in aanwezigheid van zwavelzuur (H2SO4) als katalysator. Dit wordt de zuurgekatalyseerde halogeneringsreactie genoemd. De reactie verloopt als volgt:
- HBr wordt toegevoegd aan 1-butanol in aanwezigheid van zwavelzuur.
- HBr protoneert de hydroxylgroep van 1-butanol, waardoor een goede vertrekkende groep (water) ontstaat.
- De vertrekkende groep (water) wordt vervangen door het bromide-ion (Br-) van HBr, waardoor C4H9Br ontstaat.
- Het reactiemengsel wordt vervolgens verwarmd om het C4H9Br te destilleren.
Een andere methode voor het synthetiseren van C4H9Br omvat het laten reageren van buteen met waterstofbromide in aanwezigheid van een peroxide-initiator zoals benzoylperoxide of t-butylperoxide. Dit wordt de vrije radicalen-halogeneringsreactie genoemd. De reactie verloopt als volgt:
- Buteen wordt toegevoegd aan een mengsel van waterstofbromide en een peroxide-initiator.
- De peroxide-initiator ondergaat homolytische splitsing, waarbij twee reactieve radicalen worden geproduceerd.
- De radicalen vallen de dubbele binding van buteen aan en vormen een bromideradicaal en een koolstofgecentreerd radicaal.
- Het bromideradicaal reageert vervolgens met het koolstofgecentreerde radicaal en vormt C4H9Br.
Beide methoden worden veel gebruikt voor de synthese van C4H9Br en kunnen worden geoptimaliseerd om hoge opbrengsten van het product te produceren. Het is echter belangrijk om de juiste veiligheidsmaatregelen te volgen bij het werken met gevaarlijke chemicaliën zoals HBr en peroxiden.
Gebruik van 1-broombutaan
C4H9Br is een veelzijdige chemische stof die wordt gebruikt in verschillende industriële en laboratoriumtoepassingen.
- Organisch chemici gebruiken C4H9Br als grondstof om andere organische verbindingen te synthetiseren, vooral voor de productie van farmaceutische producten en landbouwchemicaliën.
- Chemische reacties vereisen C4H9Br als oplosmiddel en fungeren als reagens bij organische synthese.
- Fabrikanten verwerken C4H9Br in smaakstoffen, geuren en andere aromatische verbindingen. Bovendien is het een onderdeel van de productie van oppervlakteactieve stoffen en wordt het veel gebruikt in schoonmaakmiddelen zoals wasmiddelen en zepen.
- C4H9Br functioneert als octaangetalverhoger in benzineadditieven en wordt gebruikt bij de productie van koelmiddelen en polymeren.
- Analytische technieken zoals gaschromatografie vereisen C4H9Br als standaard laboratoriumreferentiemateriaal. Onderwijs- en onderzoekslaboratoria voor de organische chemie gebruiken het als grondstof voor verschillende experimenten.
Over het geheel genomen maken de veelzijdige eigenschappen van C4H9Br het tot een belangrijke chemische stof op chemisch, farmaceutisch en industrieel gebied, met een breed scala aan toepassingen in organische synthese, productie en onderzoek.
Vragen:
Jouw taak is om 2-broombutaan met de hoogste opbrengst om te zetten in 1-buteen. Welke reagentia zou u gebruiken?
Om 2-broombutaan met de hoogste opbrengst om te zetten in 1-buteen, zou ik een sterke base zoals natriumethoxide (NaOEt) in ethanol als reagens gebruiken. De reactie zou verlopen als een eliminatiereactie die bekend staat als een dehydrohalogeneringsreactie.
De reactie zou als volgt verlopen:
- 2-Broombutaan wordt toegevoegd aan een oplossing van natriumethoxide in ethanol.
- De sterke base extraheert een proton uit de bètakoolstof grenzend aan het broom, waardoor een tussenproduct alkoxide-ion wordt gevormd.
- Het tussenproduct alkoxide-ion ondergaat eliminatie van de vertrekkende groep (broom), wat resulteert in de vorming van het alkeen (1-buteen) en natriumbromide.
- Het reactiemengsel wordt vervolgens gedestilleerd om het 1-buteenproduct te verwijderen.
Door een sterke base zoals NaOEt te gebruiken, kan de reactie in de richting van de vorming van 1-buteen worden gestuurd, en door ethanol als oplosmiddel te gebruiken kan de reactie relatief veilig en kosteneffectief worden uitgevoerd. Bovendien kan het gebruik van een sterke base en ethanol als oplosmiddel leiden tot hoge opbrengsten aan 1-buteen.
Waarom beginnen met 1-broombutaan voor je nai in de acetontest?
Beginnen met C4H9Br voor het NAI in de acetontest is een bruikbare manier om te bepalen of een bepaalde organische verbinding al dan niet een halogeenatoom bevat. De test omvat de toevoeging van natriumjodide (NaI) aan de organische verbinding opgelost in aceton, gevolgd door de toevoeging van een kleine hoeveelheid chloor of jodium.
De reactie vindt plaats volgens het volgende mechanisme:
- NaI wordt toegevoegd aan de organische verbinding opgelost in aceton, wat leidt tot de vorming van het natriumhalogenidezout en het overeenkomstige organische halogenide.
- Het toevoegen van een kleine hoeveelheid chloor of jodium leidt tot de vorming van een kleine hoeveelheid halogeengas, dat reageert met het natriumhalogenide om het overeenkomstige halogeengas te vormen.
- Het halogeengas reageert vervolgens met het organische halogenide en vormt een gekleurd neerslag, wat de aanwezigheid van het halogeen in de oorspronkelijke organische verbinding aangeeft.
C4H9Br is een veelgebruikte verbinding voor deze test omdat het een eenvoudige, gemakkelijk toegankelijke organische verbinding is die een halogeenatoom (broom) bevat. Het reageert ook gemakkelijk met natriumjodide en halogeengas en vormt een gekleurd neerslag, waardoor het een bruikbare testverbinding is voor het detecteren van de aanwezigheid van een halogeen in andere organische verbindingen.
