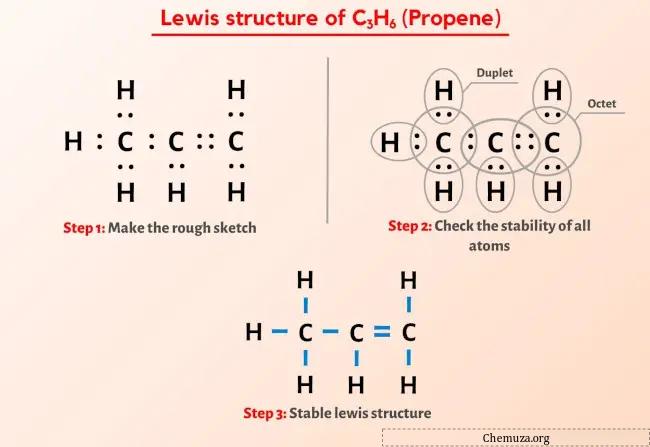
Dus je hebt de afbeelding hierboven al gezien, toch?
Ik zal het bovenstaande beeld kort toelichten.
De C3H6 (Propeen) Lewis-structuur heeft drie koolstofatomen (C) in het midden en deze zijn omgeven door waterstofatomen (H). Het bevat zes CH-obligaties, één CC-binding en één C=C-binding.
Als je niets hebt begrepen van de bovenstaande afbeelding van de Lewis-structuur van C3H6, blijf dan bij mij en je krijgt een gedetailleerde stapsgewijze uitleg over hoe je een Lewis-structuur van C3H6 tekent.
Laten we dus verder gaan met de stappen voor het tekenen van de Lewis-structuur van C3H6.
Stappen bij het tekenen van de C3H6 Lewis-structuur
Stap 1: Zoek het totale aantal valentie-elektronen in het C3H6-molecuul
Om het totale aantal valentie-elektronen in een C3H6- molecuul te vinden, moet je eerst de valentie-elektronen kennen die aanwezig zijn in het koolstofatoom en in het waterstofatoom.
(Valentie-elektronen zijn de elektronen die aanwezig zijn in de buitenste baan van elk atoom.)
Hier zal ik je vertellen hoe je gemakkelijk de valentie-elektronen van zowel koolstof als waterstof kunt vinden met behulp van een periodiek systeem.
Totale valentie-elektronen in het C3H6-molecuul
→ Valentie-elektronen gegeven door het koolstofatoom:
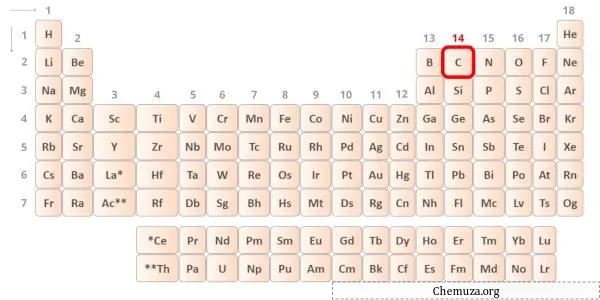
Koolstof is een element in groep 14 van het periodiek systeem. [1] Daarom zijn de valentie-elektronen in koolstof 4 .
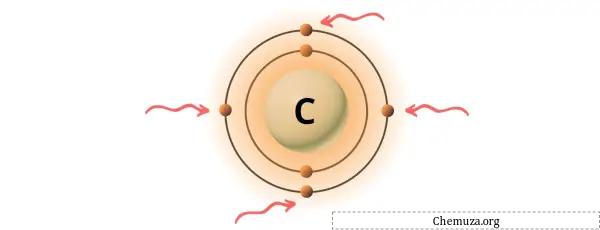
Je kunt de 4 valentie-elektronen in het koolstofatoom zien, zoals weergegeven in de afbeelding hierboven.
→ Valentie-elektronen gegeven door het waterstofatoom:
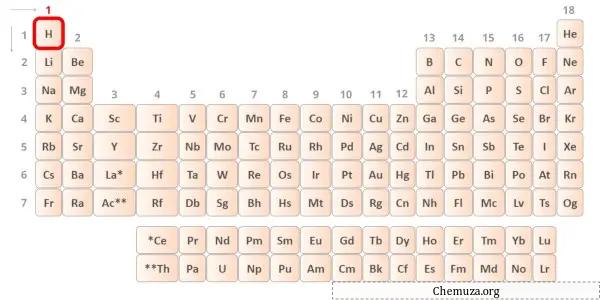
Waterstof is een element uit groep 1 van het periodiek systeem. [2] Het valentie-elektron in waterstof is dus 1 .

Je kunt zien dat er slechts één valentie-elektron aanwezig is in het waterstofatoom, zoals weergegeven in de afbeelding hierboven.
Dus,
Totale valentie-elektronen in het C3H6-molecuul = valentie-elektronen gedoneerd door 3 koolstofatomen + valentie-elektronen gedoneerd door 6 waterstofatomen = 4(3) + 1(6) = 18 .
Stap 2: Bereid de schets voor
De Lewis-structuur van propeen (C3H6) heeft drie opeenvolgende koolstofatomen met één enkele binding en één dubbele binding tussen de koolstofatomen. Waterstofatomen zijn gebonden aan koolstofatomen en vormen een enkele binding.
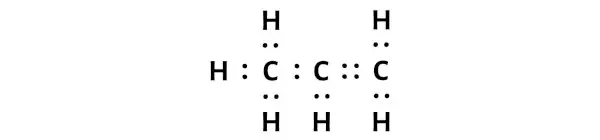
Stap 3: Controleer of alle atomen stabiel zijn of niet
In het bovenstaande diagram van het C3H6-molecuul kun je zien dat de buitenste atomen waterstofatomen zijn.
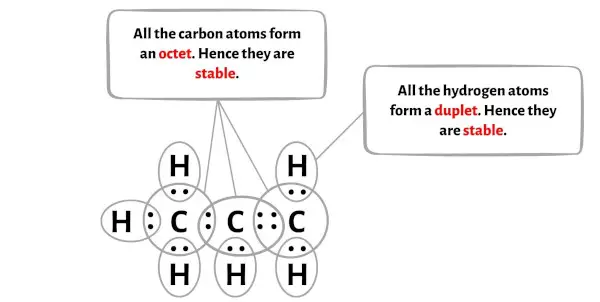
De 6 waterstofatomen vormen een duplet en zijn daardoor stabiel.
Bovendien vormen de 3 koolstofatomen een octet, dus ze zijn ook stabiel.
Daarom is de bovenstaande Lewis-structuur van propeen (C3H6) een stabiele Lewis-structuur.
In deze Lewis-puntenstructuur kun je elk paar bindende elektronen (:) ook voorstellen als een enkele binding (|). Als u dit wel doet, ontstaat de volgende Lewis-structuur van C3H6.
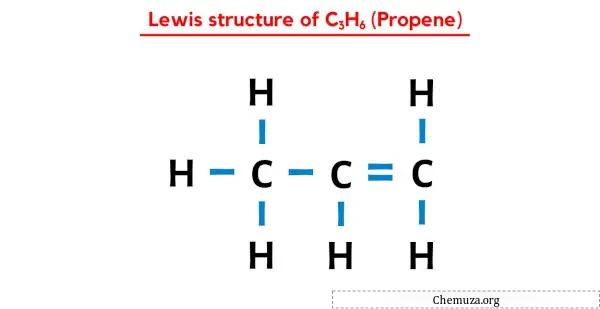
Ik hoop dat je alle bovenstaande stappen volledig hebt begrepen.
Voor meer oefening en een beter begrip kun je andere Lewis-structuren proberen die hieronder worden vermeld.
Probeer (of bekijk in ieder geval) deze Lewis-structuren voor een beter begrip:
