Ethanol of C2H6O is een kleurloze, brandbare alcohol afgeleid van plantaardig materiaal, vaak gebruikt als biobrandstof of oplosmiddel. Het is ook een veelgebruikt ingrediënt in alcoholische dranken.
| IUPAC-naam | Ethanol |
| Moleculaire formule | C2H6O |
| CAS-nummer | 64-17-5 |
| Synoniemen | Ethylalcohol, graanalcohol, EtOH, alcohol |
| InChi | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Eigenschappen van ethanol
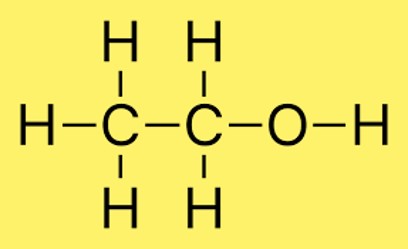
Lewis-structuur C2H6O
De Lewis-structuur voor C2H6O (ook bekend als ethanol) kan als volgt worden getekend:
HH
| |
HCCOH
| |
HH
In deze structuur zijn de twee koolstofatomen met elkaar verbonden door een enkele covalente binding. Elk koolstofatoom is ook gebonden aan drie waterstofatomen en één koolstofatoom is gebonden aan één zuurstofatoom. Het zuurstofatoom is via een enkele covalente binding met het koolstofatoom verbonden en heeft twee paar vrije elektronen.
Deze structuur voldoet aan de octetregel, die stelt dat elk atoom in het molecuul acht elektronen in zijn valentieschil moet hebben. Koolstofatomen hebben vier elektronen in hun valentieschil, terwijl waterstofatomen elk één elektron hebben. Het zuurstofatoom heeft zes valentie-elektronen en voldoet, met twee extra vrije paren, aan de octetregel.
C2H6O Molaire massa
Ethanol heeft een molaire massa van ongeveer 46,07 g/mol. De molaire massa van een stof wordt gedefinieerd als de massa van één mol van die stof. In het geval van ethanol bevat één mol ethanol ongeveer 46,07 gram van de stof. Molaire massa is een nuttige parameter bij chemische berekeningen omdat deze conversie mogelijk maakt tussen de massa en het aantal mol van een stof.
Kookpunt van ethanol
Ethanol heeft een kookpunt van ongeveer 78,5°C (173,3°F) bij standaarddruk. Dit relatief lage kookpunt vergemakkelijkt de verdamping van ethanol, wat nuttig is in veel industriële processen. Ethanol wordt bijvoorbeeld vaak gebruikt als oplosmiddel bij de productie van farmaceutische producten, parfums en andere chemicaliën.
Smeltpunt van ethanol
Ethanol heeft een smeltpunt van ongeveer -114,1°C (-173,4°F). Door dit lage smeltpunt is ethanol bij kamertemperatuur vloeibaar en daarom wordt het vaak in vloeibare vorm gebruikt als oplosmiddel of brandstof. Het smeltpunt van ethanol is lager dan dat van water, waardoor ethanol kan worden gebruikt als antivriesmiddel in koelsystemen voor auto’s.
Ethanoldichtheid g/ml
De dichtheid van ethanol is ongeveer 0,789 g/ml bij standaardtemperatuur en -druk. Dit betekent dat één milliliter ethanol 0,789 gram weegt. De dichtheid van ethanol is lager dan die van water, dat bij standaardtemperatuur en -druk een dichtheid heeft van 1 g/ml. Dit betekent dat de ethanol op het wateroppervlak blijft drijven.
Moleculair gewicht van ethanol
Het molecuulgewicht van ethanol is ongeveer 46,07 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul. In het geval van ethanol bevat het twee koolstofatomen, zes waterstofatomen en één zuurstofatoom. Het molecuulgewicht wordt gebruikt om het aantal mol van een stof in een gegeven massa van de stof te berekenen.
Structuur van ethanol
In de structuur van ethanol binden twee koolstofatomen zich via een enkele binding en binden drie waterstofatomen zich aan elk koolstofatoom. Bovendien is een waterstofatoom gebonden aan het zuurstofatoom. De rangschikking van atomen in het molecuul wordt gewoonlijk weergegeven door CH3CH2OH.
Ethanol-formule
De chemische formule voor ethanol is C2H6O. Deze formule toont het aantal en het type atomen in het molecuul. De formule kan worden gebruikt om het molecuulgewicht van ethanol te berekenen, evenals het aantal mol ethanol in een bepaalde massa van de stof. De formule is ook nuttig voor het voorspellen van het chemische gedrag van ethanol in reacties met andere chemicaliën.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,789 |
| Kleur | Kleurloos |
| Geur | Karakteristieke geur |
| Molaire massa | 46,07 g/mol |
| Dikte | 0,789 g/ml |
| Fusie punt | -114,1°C (-173,4°F) |
| Kookpunt | 78,5°C (173,3°F) bij standaarddruk |
| Flitspunt | 13°C (55°F) |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in polaire en niet-polaire oplosmiddelen |
| Dampdruk | 44,6 kPa bij 20°C |
| Dampdichtheid | 1,59 (lucht = 1) |
| pKa | 15,9 tot 25°C |
| pH | 7 (neutraal) |
Ethanolveiligheid en gevaren
Ethanol is een ontvlambare vloeistof en kan brand- en explosiegevaar opleveren als er niet op de juiste manier mee wordt omgegaan. Ethanoldampen kunnen ook gemakkelijk ontbranden en vormen een ernstig brandgevaar. Ethanol kan ook schadelijk zijn als het wordt ingenomen, en overmatige consumptie kan leiden tot alcoholvergiftiging. Het inademen van grote hoeveelheden ethanoldamp kan duizeligheid, hoofdpijn en misselijkheid veroorzaken. Langdurige blootstelling aan ethanol kan ook huidirritatie en uitdroging veroorzaken. Ethanol moet worden bewaard in een koele, goed geventileerde ruimte, uit de buurt van ontstekingsbronnen en onverenigbare stoffen. Bij het hanteren van ethanol moeten de juiste beschermende uitrusting, zoals handschoenen en een veiligheidsbril, worden gebruikt.
| Gevarensymbolen | F, Xi, Flam. Vloeibaar. 2 |
| Beveiligingsbeschrijving | Verwijderd houden van hitte, vonken, open vuur en hete oppervlakken. Niet roken. Gebruik explosieveilige elektrische, ventilatie- en verlichtingsapparatuur. Vermijd inademen van dampen. Draag beschermende handschoenen en een veiligheidsbril. In geval van brand: Gebruik droog chemisch poeder, CO2, waternevel of schuim om te blussen. Inhoud/verpakking afvoeren in overeenstemming met lokale/regionale/nationale/internationale regelgeving. |
| AN-identificaties | UN1170 |
| HS-code | 2207.10.00 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Ethanol kan giftig zijn als het in grote hoeveelheden wordt ingenomen of ingeademd. Langdurige blootstelling kan ook irritatie en uitdroging van de huid veroorzaken. Chronische inname kan leiden tot alcoholisme en andere gezondheidsproblemen. |
Methoden voor ethanolsynthese
Ethanol kan op verschillende manieren worden gesynthetiseerd, waaronder fermentatie, directe ethyleenhydratatie en biomassaconversie.
Fermentatie is de meest gebruikelijke methode voor de productie van ethanol en omvat de omzetting van suikers en andere koolhydraten in ethanol door micro-organismen zoals gist. Dit proces wordt gebruikt om ethanol te produceren uit gewassen als maïs, gerst en suikerriet, maar ook uit afvalmaterialen zoals voedselafval en landbouwresten.
Directe hydratatie van ethyleen is een andere methode om ethanol te produceren. Bij dit proces reageert ethyleen met water in aanwezigheid van een katalysator zoals fosforzuur om ethanol te vormen. Deze methode wordt vaak gebruikt in industriële omgevingen en is efficiënter dan fermentatie.
Biomassaconversie is een andere methode om ethanol te produceren en omvat de omzetting van plantaardig materiaal zoals houtsnippers, grassen en landbouwresten in ethanol. Het proces omvat het afbreken van cellulose en hemicellulose in plantaardig materiaal tot eenvoudige suikers die kunnen worden gefermenteerd tot ethanol.
Andere methoden voor de productie van ethanol zijn onder meer katalytische kooldioxide-omzetting en elektrochemische kooldioxidereductie.
Elk van deze methoden heeft zijn voor- en nadelen, en de keuze van de methode hangt af van factoren zoals beschikbaarheid van grondstoffen, kosten en effectiviteit. Fermentatie blijft de meest gebruikte methode voor de productie van ethanol vanwege de kosteneffectiviteit en betrouwbaarheid ervan.
Gebruik van ethanol
Ethanol heeft een breed scala aan industriële, commerciële en persoonlijke toepassingen. Enkele veel voorkomende toepassingen zijn:
- Ethanol verhoogt het octaangetal en vermindert de uitstoot als het als benzine-additief wordt gebruikt.
- Ethanol is een veelzijdig oplosmiddel dat vaak wordt gebruikt bij de productie van farmaceutische, cosmetische en persoonlijke verzorgingsproducten.
- Alcoholische dranken zoals bier, wijn en sterke drank bevatten ethanol als actief ingrediënt.
- Handdesinfecterende middelen, oppervlaktereinigers en andere schoonmaakproducten gebruiken ethanol als effectief desinfectiemiddel.
- Ethanol wordt gebruikt als oplosmiddel bij de extractie van essentiële oliën, smaakstoffen en andere natuurlijke verbindingen.
- Producenten gebruiken ethanol als grondstof voor de productie van andere chemicaliën, zoals azijnzuur en ethyleen.
- Producten voor persoonlijke verzorging zoals parfums, lotions en haarverzorgingsproducten gebruiken ethanol als conserveermiddel en geuringrediënt.
- Chemische laboratoria gebruiken gewoonlijk ethanol als oplosmiddel en reagens.
- Auto- en andere koelsystemen kunnen ethanol als antivriesmiddel gebruiken.
Vragen:
Uit hoeveel atomen bestaat een molecuul ethanol (C2H6O)?
Een ethanolmolecuul (C2H6O) bestaat uit 9 atomen: 2 koolstofatomen, 6 waterstofatomen en 1 zuurstofatoom.
