Butanal of butyraldehyde is een organische verbinding met de formule C4H8O. Het is een kleurloze vloeistof met een scherpe geur en wordt vaak gebruikt als grondstof voor de synthese van andere chemicaliën.
| IUPAC-naam | Butanaal |
| Moleculaire formule | C4H8O |
| CAS-nummer | 123-72-8 |
| Synoniemen | Butyraldehyde, butyraldehyde, butaanaldehyde, butyral, N-butanal, butaldehyde, butyrylhydride, 1-butanal, 1-butyraldehyde |
| InChi | InChI=1S/C4H8O/c1-2-3-4-5/h4H,2-3H2,1H3 |
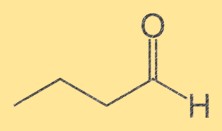
Butanale structuur
De structuur van Butanal bestaat uit een keten van vier koolstofatomen waaraan een terminale aldehydegroep (-CHO) is bevestigd. De koolstofatomen zijn opeenvolgend genummerd, waarbij de aldehydegroep aan het eerste koolstofatoom is bevestigd. De structuur van Butanal is belangrijk omdat deze de chemische en fysische eigenschappen ervan bepaalt.
Butanaal IR-spectrum
Het infrarood (IR) spectrum van Butanal wordt gebruikt om de functionele groepen in het molecuul te identificeren. Het IR-spectrum van Butanal vertoont karakteristieke pieken voor de carbonylgroep (-C=O) bij ongeveer 1730 cm-1, en voor CH-strekvibraties bij ongeveer 2800-3000 cm-1. Het IR-spectrum is een krachtig hulpmiddel in de organische chemie om verbindingen te identificeren en karakteriseren.
Molaire massa van butanal
Butanal heeft een molaire massa van 72,11 g/mol. De molaire massa van een verbinding is de som van de atoommassa’s van alle atomen in een molecuul van die verbinding. In het geval van Butanal wordt de molaire massa berekend door de atoommassa’s van vier koolstofatomen, acht waterstofatomen en één zuurstofatoom op te tellen.
Kookpunt van butanal
Het kookpunt van Butanal is 75°C of 167°F. Dit is de temperatuur waarbij de dampdruk van de vloeistof gelijk is aan de atmosferische druk en de vloeistof begint te koken. Butanal heeft een relatief laag kookpunt, waardoor het vluchtig is en gemakkelijk verdampt bij kamertemperatuur.
Smeltpunt van butanal
Het smeltpunt van Butanal is -97°C of -143°F. Dit is de temperatuur waarbij een vaste stof overgaat in een vloeibare toestand. Butanal heeft een zeer laag smeltpunt, wat betekent dat het bij kamertemperatuur meestal in vloeibare toestand is.
Dichtheid van butyraldehyde g/ml
De dichtheid van butyraldehyde is 0,81 g/ml. De dichtheid is de hoeveelheid massa per volume-eenheid en wordt voor vloeistoffen meestal uitgedrukt in gram per milliliter. Butyraldehyde heeft een lagere dichtheid dan water, wat betekent dat het op het wateroppervlak drijft.
Molecuulgewicht van butyraldehyde
Het molecuulgewicht van butyraldehyde is 72,11 g/mol. Het is hetzelfde als de molaire massa en vertegenwoordigt de massa van een butyraldehydemolecuul. Molecuulgewicht is een belangrijke parameter die wordt gebruikt bij chemische berekeningen en analyses.
Butyraldehyde-formule
De chemische formule voor butyraldehyde is C4H8O. Deze formule geeft het aantal atomen van elk element in een butyraldehydemolecuul aan. Er zijn vier koolstofatomen, acht waterstofatomen en één zuurstofatoom in butyraldehyde.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 0,81 g/ml |
| Kleur | Kleurloos |
| Geur | Kruidig, scherp |
| Molaire massa | 72,11 g/mol |
| Dikte | 0,81 g/ml |
| Fusie punt | -97°C (-143°F) |
| Kookpunt | 75°C (167°F) |
| Flitspunt | -6,7°C (20°F) |
| oplosbaarheid in water | Mengbaar |
| Oplosbaarheid | Oplosbaar in ethanol, ether, aceton |
| Dampdruk | 44 mmHg bij 20°C |
| Dampdichtheid | 2,5 (lucht=1) |
| pKa | 16.92 |
| pH | 4,5-6,5 |
Veiligheid en gevaren van butanal
Butyraldehyde is een ontvlambare vloeistof en kan brandgevaar opleveren bij blootstelling aan hitte of vlammen. Het kan bij contact ook oog- en huidirritatie veroorzaken, en het inademen van dampen kan irritatie van de luchtwegen veroorzaken. Daarom is het belangrijk om voorzichtig met butyraldehyde om te gaan en geschikte persoonlijke beschermingsmiddelen te dragen, zoals handschoenen en een veiligheidsbril. Het moet worden bewaard op een koele, droge, goed geventileerde plaats, uit de buurt van hitte- en ontstekingsbronnen. Indien blootgesteld of ingeslikt, dient u onmiddellijk medische hulp in te roepen. Het is ook belangrijk om de juiste afvalverwerkingsprocedures voor butyraldehyde te volgen om verontreiniging van het milieu te voorkomen.
| Gevarensymbolen | Vlam, bijtend, irriterend |
| Beveiligingsbeschrijving | Verwijderd houden van hitte/vonken/open vuur/hete oppervlakken. Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. BIJ CONTACT MET DE HUID (of het haar): Verwijder onmiddellijk alle verontreinigde kleding. Huid afspoelen met water/douchen. In geval van brand: Gebruik droog chemisch poeder om te blussen. |
| VN-identificatienummers | UN1125 |
| HS-code | 2912.19.00 |
| Gevarenklasse | 3 |
| Verpakkingsgroep | II |
| Toxiciteit | Butanal is schadelijk als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Het kan oog- en huidirritatie veroorzaken en langdurige blootstelling kan leiden tot lever- en nierschade. Uit dierstudies is ook gebleken dat het mutageen en carcinogeen is. Een juiste behandeling en verwijdering is belangrijk om blootstelling en besmetting te voorkomen. |
Butanale synthesemethoden
Butyraldehyde kan op verschillende manieren worden gesynthetiseerd, waaronder oxidatie van primaire alcoholen, ozonolyse van alkenen en hydroformylering van alkenen.
Een gebruikelijke methode voor het synthetiseren van butyraldehyde is de oxidatie van primaire alcoholen met behulp van een oxidatiemiddel zoals kaliumpermanganaat of chroomzuur. De primaire alcohol wordt eerst omgezet in het overeenkomstige aldehyde met behulp van een mild reductiemiddel zoals pyridiniumchloorchromaat en vervolgens geoxideerd tot butyraldehyde. Een andere methode omvat ozonolyse van alkenen om aldehyden te produceren, die vervolgens kunnen worden gereduceerd tot butyraldehyde met behulp van een reductiemiddel zoals natriumboorhydride.
Hydroformylering van alkenen is ook een veelgebruikte methode om butyraldehyde te synthetiseren. Dit omvat een reactie van het alkeen met koolmonoxide en waterstofgas in aanwezigheid van een katalysator zoals kobaltcarbonyl of rhodiumcomplex. Het resulterende aldehyde kan vervolgens worden gereduceerd tot butyraldehyde met behulp van een reductiemiddel zoals lithiumaluminiumhydride.
Andere methoden voor het synthetiseren van butyraldehyde omvatten de reactie van Grignard-reagentia met formaldehyde en de reactie van ketonen met mierenzuur en waterstofgas in aanwezigheid van een katalysator.
Over het algemeen hangt de keuze van de synthesemethode af van factoren zoals de beschikbaarheid van grondstoffen, de gewenste opbrengst en zuiverheid, en de haalbaarheid van de reactieomstandigheden.
Gebruik van butanal
Butanal heeft verschillende industriële en commerciële toepassingen vanwege zijn reactiviteit en duidelijke geur.
Een belangrijk gebruik van Butanal is als grondstof voor de productie van andere chemicaliën, zoals butylacrylaat en n-butanol. Deze chemicaliën worden gebruikt bij de vervaardiging van coatings, lijmen en kunststoffen.
Butanal wordt ook gebruikt als smaakstof in de voedingsindustrie en geeft een fruitig, appelachtig aroma aan verschillende producten, zoals gebak, snoep en dranken. Het wordt ook gebruikt als geurstof in parfums en zepen.
Bovendien wordt Butanal gebruikt als oplosmiddel bij organische synthese en als reagens bij organisch-chemische reacties. Het kan worden gebruikt om aldehyden om te zetten in secundaire alcoholen en om esters te produceren door te reageren met carbonzuren.
Butanal is ook gebruikt in onderzoeksstudies als een hulpmiddel om de mechanismen van reukreceptoractivering in de hersenen te begrijpen, vanwege de sterke geur.
Het is echter belangrijk op te merken dat Butanal veiligheidsrisico’s kan opleveren als het niet op de juiste manier wordt behandeld, en dat er passende voorzorgsmaatregelen moeten worden genomen bij het gebruik en de opslag ervan. Over het geheel genomen maken de veelzijdigheid en unieke eigenschappen van Butanal het tot een belangrijke chemische stof in verschillende industrieën en onderzoeksgebieden.
Vragen:
Wat is de standaard-enthalpie voor de vorming van vloeibaar butyraldehyde, ch3ch2ch2cho(l)?
De standaard vormingsenthalpie (∆H°f) van vloeibaar butyraldehyde (CH3CH2CH2CHO(l)) bij 25°C is -146,6 kJ/mol.
Dit betekent dat de enthalpieverandering die gepaard gaat met de vorming van 1 mol vloeibaar butyraldehyde uit de samenstellende elementen in hun standaardtoestanden (in dit geval koolstof, waterstof en zuurstof in hun elementaire vormen) -146,6 kJ/mol is bij 25°C. . en 1 atm druk.
Het negatieve teken geeft aan dat de reactie exotherm is, wat betekent dat er warmte vrijkomt. Deze waarde is nuttig voor het berekenen van de enthalpieverandering van reacties waarbij butyraldehyde als reactant of product betrokken is.
