Broomthymolblauw (BTB) is een pH-indicator die van kleur verandert van geel naar blauw in aanwezigheid van een basische oplossing. Het wordt vaak gebruikt in wetenschappelijke experimenten en als medisch diagnostisch hulpmiddel.
| IUPAC-naam | 3′,3”-dibroomthymolsulfonftaleïne |
| Moleculaire formule | C27H28Br2O5S |
| CAS-nummer | 76-59-5 |
| Synoniemen | broomthymolsulfonftaleïne; 4,4′-(1,1-dioxido-3H-2,1-benzoxathiole-3,3-diyl)bis(2-broom-3-methyl-6-(1-methylethyl)fenol) |
| InChi | InChI=1S/C27H28Br2O5S/c1-13(2)17-11-20(15(5)23(28)18(17)7-9-19(24(20)29)8-10-21(27) 22(30)12-25(31)32)37(33,34)36-26-14(3)6-4-16(35-26)24-7-9-29-11-10-23( 24)28/u4-7,9-12,31-32H.8H2.1-3H3 |
Broomthymol Blauw Molaire Massa
BTB heeft een molaire massa van 624,38 g/mol. Molaire massa is de massa van één mol van een stof en wordt vaak gebruikt bij berekeningen waarbij chemische reacties betrokken zijn. De molaire massa van BTB wordt berekend door de atoomgewichten van alle atomen in de chemische formule, die C27H28Br2O5S is, bij elkaar op te tellen. Het kennen van de molaire massa van een stof is belangrijk voor het bepalen van de hoeveelheid stof die nodig is voor een bepaalde reactie, evenals voor het bepalen van de hoeveelheid product die bij een reactie wordt geproduceerd.
Kookpunt van broomthymolblauw
BTB heeft een kookpunt van 636,3°C bij 760 mmHg. Het kookpunt is de temperatuur waarbij een stof bij een bepaalde druk overgaat van zijn vloeibare toestand naar zijn gasvormige toestand. Het hoge kookpunt van BTB geeft aan dat het een stabiele verbinding is die onder normale omstandigheden niet gemakkelijk verdampt of ontleedt. Het kookpunt van een stof kan worden gebruikt om de zuiverheid ervan te bepalen, omdat onzuiverheden het kookpunt kunnen veranderen.
Broomthymolblauw Smeltpunt
BTB heeft een smeltpunt van 165-170°C. Het smeltpunt is de temperatuur waarbij een vaste stof overgaat van de vaste toestand naar de vloeibare toestand. Het smeltpunt van een stof wordt gebruikt om deze te identificeren en te karakteriseren, omdat verschillende stoffen verschillende smeltpunten hebben. Het smeltpunt van BTB is relatief hoog, wat aangeeft dat het een stabiele verbinding is die niet gemakkelijk ontleedt.
Broomthymolblauw Dichtheid g/ml
BTB heeft een dichtheid van 1,36 g/ml. Dichtheid is de massa van een stof per volume-eenheid en meet hoe dicht de moleculen in een stof zijn. De dichtheid van BTB geeft aan dat het een relatief dichte verbinding is en vaak als standaard wordt gebruikt bij dichtheidsmetingen.
Broomthymolblauw Molecuulgewicht
Het molecuulgewicht van BTB is 624,38 g/mol. Het molecuulgewicht is de som van de atoomgewichten van alle atomen in een molecuul en is een belangrijke factor bij chemische reacties. Het molecuulgewicht van BTB wordt gebruikt om de hoeveelheid stof te bepalen die nodig is voor een bepaalde reactie, evenals om de hoeveelheid product te bepalen die bij een reactie wordt geproduceerd.
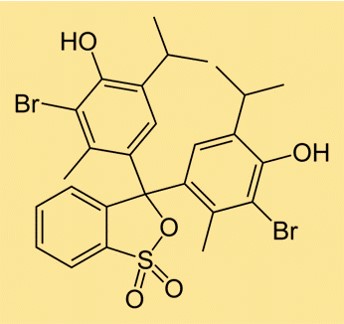
Structuur van broomthymolblauw
De structuur van BTB bestaat uit twee aromatische ringen, waaraan elk een broomatoom is bevestigd. Aan één van de ringen zit ook een sulfonaatgroep, waardoor het molecuul oplosbaar is in water. De structuur van BTB is vergelijkbaar met andere pH-indicatoren, die worden gebruikt om de zuurgraad of basiciteit van een oplossing te bepalen.
Broomthymolblauw-formule
De chemische formule van BTB is C27H28Br2O5S. De formule geeft het aantal en de soorten atomen in het molecuul aan en wordt gebruikt bij chemische reacties om de hoeveelheid stof te bepalen die nodig is voor een bepaalde reactie. De formule voor BTB laat zien dat het twee broomatomen bevat, waardoor het zijn kenmerkende geelgroene kleur krijgt in zure oplossingen, en een sulfonaatgroep, waardoor het oplosbaar is in water.
| Verschijning | Donkergroen poeder |
| Soortelijk gewicht | 1.36 |
| Kleur | geelachtig groen |
| Geur | Geurloos |
| Molaire massa | 624,38 g/mol |
| Dikte | 1,36 g/ml |
| Fusie punt | 165-170°C |
| Kookpunt | 636,3°C bij 760 mmHg |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Oplosbaar |
| Oplosbaarheid | Oplosbaar in ethanol, enigszins oplosbaar in ether en chloroform |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | 6.3 |
| pH | Geel bij pH 6,0, groen bij pH 7,6, blauw bij pH 7,9 |
Veiligheid en gevaren van broomthymolblauw
BTB kan schadelijk zijn als het wordt ingeslikt, ingeademd of via de huid wordt opgenomen. Dit kan irritatie aan de ogen, huid en luchtwegen veroorzaken. Inslikken kan maag-darmirritatie, misselijkheid, braken en buikpijn veroorzaken. Inademing van BTB-stof of -damp kan irritatie van de luchtwegen, hoesten en ademhalingsmoeilijkheden veroorzaken. De stof kan ook schadelijk zijn voor het waterleven en mag niet in waterbronnen worden weggegooid. Bij het hanteren van BTB moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en oogbescherming, worden gedragen en deze moeten worden gebruikt en afgevoerd in overeenstemming met de toepasselijke laboratoriumprocedures en -voorschriften.
| Gevarensymbolen | Geen |
| Beveiligingsbeschrijving | S22: Stof niet inademen. S24/25: Vermijd contact met huid en ogen. S36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming. |
| AN-identificaties | Niet gereguleerd |
| HS-code | 2921.59.90 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | LD50 (oraal, rat) = 4.500 mg/kg |
Methoden voor de synthese van broomthymolblauw
Er zijn verschillende methoden om BTB te synthetiseren.
Een gebruikelijke methode is de reactie tussen thymolblauw en broom in aanwezigheid van een sterk zure katalysator, zoals zoutzuur. De reactie verloopt door elektrofiele toevoeging van broom aan het thymolblauwmolecuul, gevolgd door de vervanging van een waterstofatoom door een broomatoom. De resulterende verbinding is BTB.
Een andere methode omvat de reactie tussen 2,6-dibroomindofenol en cresolrood in aanwezigheid van een sterk zure katalysator. De reactie vindt plaats door elektrofiele substitutie van een waterstofatoom in het cresolroodmolecuul met een broomatoom in het 2,6-dibroomindofenolmolecuul. De resulterende verbinding is BTB.
Een derde methode omvat de reactie tussen thymolblauw en natriumbromide in aanwezigheid van natriumhydroxide. De reactie vindt plaats door een waterstofatoom in het thymolblauwmolecuul te vervangen door een broomatoom uit het natriumbromidemolecuul. De resulterende verbinding is BTB.
Ongeacht de gebruikte methode moet het resulterende product worden gezuiverd door herkristallisatie of kolomchromatografie om zuiver BTB te verkrijgen.
Gebruik van broomthymolblauw
BTB kent meerdere toepassingen op diverse terreinen. Enkele toepassingen van BTB zijn onder meer:
- Indicator: Gebruikt als zuur-base-indicator, met een pH-bereik van 6,0 tot 7,6. Bij pH 6,0 is het geel, bij pH 7,6 is het groen en bij pH 7,9 is het blauw.
- Laboratoriumexperimenten: Gebruikt in verschillende laboratoriumexperimenten om te testen op de aanwezigheid van kooldioxide en andere gassen en om het ademhalingsquotiënt te bepalen.
- Aquacultuur: Gebruikt in de aquacultuur om de pH-waarde van water in aquaria en vijvers te controleren.
- Medisch gebied: Gebruikt om te testen op de aanwezigheid van gal in urinemonsters en om de aanwezigheid van schimmelinfecties op te sporen.
- Educatie: Gebruikt in het onderwijs als visueel hulpmiddel om de principes van zuur-base-reacties te demonstreren en om studenten over pH-niveaus te leren.
- Agrarische industrie: Wordt gebruikt om de pH-waarde van de bodem te meten, een belangrijke factor bij het bepalen van de gezondheid en groei van planten.
- Milieutesten: Gebruikt bij milieutests om de pH-niveaus van waterbronnen, zoals meren en rivieren, te meten om hun geschiktheid voor het waterleven te garanderen.
Over het geheel genomen is BTB een veelzijdige verbinding met veel toepassingen op verschillende gebieden.
Vragen:
Vraag: Wat is broomthymolblauw?
A: BTB is een pH-indicator die vaak wordt gebruikt in laboratoriumexperimenten en diverse andere toepassingen. Het is een chemische verbinding die van kleur verandert afhankelijk van de zuurgraad of alkaliteit van een oplossing.
Vraag: Wat is het pH-bereik van broomthymolblauw?
A: Het pH-bereik van BTB ligt tussen 6,0 en 7,6. Bij pH 6,0 is het geel, bij pH 7,6 is het groen en bij pH 7,9 is het blauw.
Vraag: Wat is de kleurverandering van broomthymolblauw?
A: De kleurverandering van BTB hangt af van de pH van de oplossing. Bij pH 6,0 is het geel, bij pH 7,6 is het groen en bij pH 7,9 is het blauw.
Vraag: Is broomthymolblauw een zuur of een base? A: BTB is noch een zuur, noch een base. Het is een indicator die van kleur verandert afhankelijk van de zuurgraad of alkaliteit van een oplossing.
