Boortrichloride (BCl3) is een verbinding bestaande uit drie chlooratomen gebonden aan één booratoom. Het wordt gebruikt in verschillende industriële processen, zoals katalysatoren en als reagens bij organische synthese.
| IUPAC-naam | Boortrichloride |
| Moleculaire formule | BCl3 |
| CAS-nummer | 10294-34-5 |
| Synoniemen | Trichloorboraan; Boor(III)chloride, trichloorboraan, trichloorboring |
| InChi | InChI=1S/BCl3/c2-1(3)4 |
Eigenschappen van boortrichloride
Boriumtrichloride-formule
De formule voor boorchloride is BCl3, wat staat voor één booratoom gebonden aan drie chlooratomen. Dit is een eenvoudige en duidelijke moleculaire formule die de samenstelling van deze verbinding beschrijft.
Boortrichloride Molaire massa
De molaire massa van boorchloride kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Borium heeft een atoommassa van ongeveer 10,81 gram per mol en elk chlooratoom heeft een atoommassa van ongeveer 35,45 gram per mol. Daarom is de molaire massa van BCl3 ongeveer 117,17 gram per mol.
Kookpunt van boortrichloride
Boorchloride heeft een relatief laag kookpunt vergeleken met veel andere verbindingen. Het kookt rond -15,7 graden Celsius of 3,77 graden Fahrenheit. Dit betekent dat bij temperaturen boven dit punt boorchloride overgaat van een vloeibare fase naar een gasfase.
Boortrichloride Smeltpunt
Het smeltpunt van boorchloride is relatief laag. Het smelt rond -107,5 graden Celsius of -161,5 graden Fahrenheit. Bij temperaturen onder dit punt verandert de verbinding van een vaste naar een vloeibare toestand.
Dichtheid van boortrichloride g/ml
De dichtheid van boorchloride is ongeveer 1,38 gram per milliliter. Deze waarde geeft de massa van de verbinding per volume-eenheid aan. Het is nuttig voor het bepalen van het gedrag van boorchloride in verschillende toepassingen en voor het begrijpen van de fysische eigenschappen ervan.
Boortrichloride Molecuulgewicht
Het molecuulgewicht van boorchloride is ongeveer 117,17 gram per mol. Deze waarde vertegenwoordigt de som van de atoommassa’s van alle atomen in een molecuul van de verbinding en is nuttig voor verschillende berekeningen, zoals het bepalen van de hoeveelheid boorchloride in een bepaald monster.
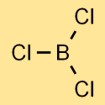
Structuur van boortrichloride
Boorchloride heeft een trigonale vlakke moleculaire structuur. Het bestaat uit een booratoom in het midden gebonden aan drie chlooratomen, gerangschikt in een driehoekige vorm. Deze structuur draagt bij aan de fysische en chemische eigenschappen van de verbinding.
Oplosbaarheid van boortrichloride
Boorchloride heeft een lage oplosbaarheid in water. Het is slecht oplosbaar, wat betekent dat het slechts in beperkte mate oplost in waterige oplossingen. Het is echter beter oplosbaar in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof. De oplosbaarheid van boorchloride beïnvloedt het gedrag ervan in verschillende chemische reacties en industriële processen.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 1.369 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 117,17 g/mol |
| Dikte | 1,38 g/ml |
| Fusie punt | -107,5°C |
| Kookpunt | -15,7°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals benzeen en tetrachloorkoolstof |
| Dampdruk | 623 mmHg bij 20°C |
| Dampdichtheid | 3,24 (lucht = 1) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van boortrichloride
Boriumchloride brengt verschillende veiligheids- en risicooverwegingen met zich mee. Het is bijtend en kan bij contact ernstige brandwonden aan de huid, ogen en luchtwegen veroorzaken. Inademing van de dampen kan irritatie van de luchtwegen en longschade veroorzaken. De verbinding is ook zeer reactief met water, waarbij giftig waterstofchloridegas vrijkomt. Het is essentieel om voorzichtig met boorchloride om te gaan, de juiste persoonlijke beschermingsmiddelen te gebruiken en voor voldoende ventilatie te zorgen. In geval van accidentele blootstelling is onmiddellijke medische hulp noodzakelijk. Bovendien moeten de juiste opslag- en hanteringsprocedures worden gevolgd om het risico van brand, explosie en het vrijkomen van gevaarlijke gassen te voorkomen.
| Gevarensymbolen | Corrosief (C) |
| Beveiligingsbeschrijving | Draag beschermende handschoenen/oogbescherming/gelaatsbescherming. Stof/rook/gas/nevel/damp/spuitnevel niet inademen. Hanteren in een goed geventileerde ruimte. |
| VN-identificatienummers | VN1741 |
| HS-code | 2827390000 |
| Gevarenklasse | 8 (Bijtende stoffen) |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig bij inslikken of inademen. Kan ernstige brandwonden en irritatie van de luchtwegen veroorzaken. Ga uiterst voorzichtig te werk. |
Methoden voor de synthese van boortrichloride
Eén methode voor het synthetiseren van boorchloride omvat de reactie tussen booroxide (B2O3 ) en tetrachloorkoolstof (CCl4) in aanwezigheid van een katalysator zoals aluminiumchloride (AlCl3) . B2O3 en CCl4 reageren bij hoge temperaturen, waarbij boorchloride en kooldioxide als bijproducten ontstaan.
Een andere benadering is de directe reactie tussen boor en chloorgas. Onder gecontroleerde omstandigheden reageert boor met chloor, wat resulteert in de vorming van boorchloride. Deze methode vereist een zorgvuldige omgang met chloorgas vanwege het gevaarlijke karakter ervan.
Thionylchloride (SOCl2) maakt de synthese van boorchloride mogelijk door boor te laten reageren met SOCl2 bij verhoogde temperaturen, wat resulteert in de productie van boorchloride en zwaveldioxidegas.
Deze synthesemethoden bieden haalbare routes voor de productie van boorchloride, zowel in het laboratorium als in industriële omgevingen. Het is van cruciaal belang om tijdens de synthese de juiste veiligheidsmaatregelen te treffen, zoals werken in goed geventileerde ruimtes en het gebruik van geschikte beschermende uitrusting. Dit is belangrijk vanwege de gevaarlijke aard van de reagentia en producten die bij het proces betrokken zijn.
Schrijf het gebruik van boortrichloride op
Boorchloride wordt veel gebruikt in de katalyse, de productie van halfgeleiders, de materiaalsynthese en diverse andere industrieën vanwege zijn unieke chemische eigenschappen en veelzijdigheid.
- Boriumchloride (BCl3) vindt toepassing als katalysator in diverse chemische reacties, vooral in de organische synthese. Het vergemakkelijkt de vorming van koolstof-koolstof- en koolstof-heteroatoombindingen bij de productie van farmaceutische producten, landbouwchemicaliën en fijne chemicaliën.
- BCl3 dient als reagens bij de synthese van op boor gebaseerde polymeren, zoals polyborazyleen, die toepassingen hebben in vlamvertragende en hogetemperatuurcoatings.
- BCl3 vergemakkelijkt de productie van boornitride, een materiaal dat bekend staat om zijn uitzonderlijke thermische en chemische stabiliteit, dat veel wordt gebruikt bij toepassingen bij hoge temperaturen en als smeermiddel.
- De halfgeleiderindustrie gebruikt BCl3 als doteermiddel om booratomen in siliciumkristallen op te nemen, waardoor hun elektrische eigenschappen worden verbeterd en ze geschikt worden gemaakt voor gebruik in elektronische apparaten.
- In de metallurgie fungeert BCl3 als een vloeimiddel om oxide-onzuiverheden te verwijderen tijdens het raffineren van metalen, waardoor hun zuiverheid wordt verbeterd.
- BCl3 speelt een centrale rol bij de productie van boorcarbide, een lichtgewicht en sterk materiaal dat veel wordt gebruikt bij de productie van keramische pantsers en snijgereedschappen.
- BCl3 speelt een cruciale rol bij de synthese van veel boorhoudende verbindingen, waaronder booresters, boorzuren en boranen. Deze verbindingen hebben veel toepassingen in chemisch onderzoek en industriële processen.
- In de aardolie-industrie wordt BCl3 gebruikt als additief om het octaangetal van benzine te verhogen.
Het dient als boorbron bij de productie van boorhoudend glas, dat gewenste optische en thermische eigenschappen heeft.
Vragen:
Vraag: Wat is de formule voor boortrichloride?
A: De formule voor boorchloride is BCl3.
Vraag: Is boortrichloride polair?
A: Ja, boorchloride is een polair molecuul vanwege de aanwezigheid van een vrij doublet op het booratoom en de asymmetrische opstelling van de chlooratomen.
Vraag: Wat is boorhybridisatie in boortrichloride (BCl3)?
A: De hybridisatie van boor in BCl3 is sp2.
Vraag: Wat is de massa van een molecuul boortrichloride?
A: De massa van een molecuul boorchloride (BCl3) is ongeveer 117,17 gram per mol.
Vraag: Wat is boortrichloride-hybridisatie?
A: De hybridisatie van boor in boorchloride (BCl3) is sp2.
Vraag: Wat gebeurt er als je boortrichloride en waterstof mengt?
A: Wanneer boorchloride (BCl3) wordt gemengd met waterstof (H2), reageren ze om boor- en waterstofchloridegas (HCl) te vormen.
Vraag: Waarom bestaat boortrichloride als monomeer, terwijl aluminiumtrichloride als dimeer bestaat?
A: Het verschil in grootte en elektronendichtheid tussen boor- en aluminiumatomen zorgt ervoor dat boorchloride (BCl3) als monomeer bestaat, terwijl aluminiumchloride (AlCl3) een dimeer vormt vanwege zijn vermogen om gecoördineerde verbindingen te vormen.
Vraag: Is BCl3 een Lewis-zuur?
A: Ja, BCl3 is een Lewis-zuur omdat het een paar elektronen van een Lewis-base kan accepteren.
Vraag: Is BCl3 ionisch of covalent?
A: BCl3 is een covalente verbinding.
Vraag: Is BCl3 een covalente binding?
A: Ja, BCl3 bestaat uit covalente bindingen tussen boor- en chlooratomen.
Vraag: Is BCl3 een gas?
A: Ja, BCl3 is een standaardtemperatuur- en drukgas (STP).
Vraag: Is BCl3 een polair of niet-polair molecuul?
A: BCl3 is een polair molecuul vanwege de ongelijkmatige verdeling van de elektronendichtheid, veroorzaakt door de asymmetrische opstelling van de chlooratomen rond het booratoom.
