Boortribromide (BBr3) is een chemische verbinding die als katalysator bij verschillende reacties wordt gebruikt. Het bestaat uit één booratoom en drie broomatomen.
| IUPAC-naam | Boortribromide |
| Moleculaire formule | BBr3 |
| CAS-nummer | 10294-33-4 |
| Synoniemen | Tribroomboraan; Boorbromide; Boor(III)bromide; Bromobore; Boortribromide, [B(Br)3]; Tribromo-boraan |
| InChi | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Eigenschappen van boortribromide
Boriumtribromide-formule
De formule voor boorbromide is BBr3. Het bestaat uit één booratoom en drie broomatomen. Deze chemische verbinding wordt gevormd door de combinatie van boor en broom.
Boortribromide Molaire massa
De molaire massa van boorbromide (BBr3) kan worden berekend door de atoommassa’s van boor en drie broomatomen bij elkaar op te tellen. Borium heeft een atoommassa van ongeveer 10,81 gram per mol en broom heeft een atoommassa van ongeveer 79,90 gram per mol. De molaire massa van BBr3 is dus ongeveer 250,60 gram per mol.
Kookpunt van boortribromide
Boriumbromide heeft een relatief laag kookpunt. Het begint te koken bij ongeveer 91 graden Celsius (196 graden Fahrenheit). Bij deze temperatuur ondergaat de verbinding een faseverandering van een vloeistof naar een gas, waarbij BBr3-dampen vrijkomen.
Boortribromide Smeltpunt
Het smeltpunt van boorbromide is relatief hoog. Het begint te smelten rond -46 graden Celsius (-51 graden Fahrenheit). Bij deze temperatuur verandert de vaste verbinding in de vloeibare toestand.
Dichtheid van boortribromide g/ml
Boriumbromide heeft een dichtheid van ongeveer 2,63 gram per milliliter (g/ml). Deze dichtheid geeft de massa BBr3 aan die aanwezig is in één milliliter van de verbinding. Het is een maat voor de compactheid of concentratie van de stof.
Boortribromide Molecuulgewicht
Het molecuulgewicht van boorbromide (BBr3) wordt berekend door de atoommassa’s van boor en drie broomatomen op te tellen. Het molecuulgewicht van BBr3 is ongeveer 250,60 gram per mol.
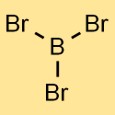
Structuur van boortribromide
De structuur van boorbromide bestaat uit één booratoom gebonden aan drie broomatomen. De opstelling vormt een trigonale vlakke geometrie, waarbij het booratoom zich in het midden bevindt en de drie broomatomen er gelijkmatig omheen verdeeld zijn.
Oplosbaarheid van boortribromide
Boriumbromide is een zeer reactieve verbinding en over het algemeen slecht oplosbaar in water. Het heeft de neiging te reageren met water en waterstofbromide en boorzuur te vormen. BBr3 is echter oplosbaar in organische oplosmiddelen zoals chloroform, tetrachloorkoolstof en koolstofdisulfide.
| Verschijning | Kleurloze vloeistof |
| Soortelijk gewicht | 2,63 g/ml |
| Kleur | Kleurloos |
| Geur | Akko |
| Molaire massa | 250,60 g/mol |
| Dikte | 2,63 g/ml |
| Fusie punt | -46°C |
| Kookpunt | 91°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Reageert |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals chloroform, CCl4 en koolstofdisulfide |
| Dampdruk | 78 mmHg |
| Dampdichtheid | 6,52 (lucht=1) |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Veiligheid en gevaren van boortribromide
Boriumbromide brengt enkele veiligheidsrisico’s met zich mee en voorzichtigheid is geboden bij het hanteren van deze verbinding. Het is bijtend voor de huid, ogen en luchtwegen. Direct contact kan brandwonden en ernstige irritatie veroorzaken. Inademing van de dampen kan ademhalingsproblemen veroorzaken. Het reageert krachtig met water, waarbij giftige dampen vrijkomen. Daarom moet het in een goed geventileerde ruimte worden gehanteerd en moeten geschikte persoonlijke beschermingsmiddelen, zoals handschoenen en een veiligheidsbril, worden gedragen. Het moet uit de buurt van vocht en onverenigbare stoffen worden bewaard. Bij blootstelling is onmiddellijke medische aandacht noodzakelijk. De juiste veiligheidsprotocollen en richtlijnen moeten worden gevolgd om de risico’s die verband houden met boorbromide tot een minimum te beperken.
| Gevarensymbolen | Bijtend, gevaarlijk als het nat is |
| Beveiligingsbeschrijving | Vermijd contact met huid, ogen en kleding. Gebruik in een goed geventileerde ruimte. Draag handschoenen en een veiligheidsbril. |
| VN-identificatienummers | UN3264 |
| HS-code | 2811.19.9000 |
| Gevarenklasse | 8 |
| Verpakkingsgroep | II |
| Toxiciteit | Giftig bij inademing en inslikken; veroorzaakt ernstige brandwonden op de huid en oogletsel. |
Methoden voor de synthese van boortribromide
Boorbromide kan op verschillende manieren worden gesynthetiseerd. Een veelgebruikte methode is de reactie tussen booroxide (B2O3) en broom (Br2). De reactie vindt plaats in aanwezigheid van een katalysator, zoals koolstof of aluminium, bij verhoogde temperaturen. Bij de resulterende reactie ontstaat boorbromide en komt er zuurstofgas vrij.
Een andere methode omvat de reactie tussen boortrichloride (BCl3) en broom. Deze reactie vindt plaats bij kamertemperatuur en vormt boorbromide en chloorgas als bijproducten.
Om boorbromide te bereiden, kan boor in een gecontroleerde omgeving met een overmaat broom worden gereageerd, waarbij hoge temperaturen en zorgvuldige controle van de reactieomstandigheden nodig zijn.
Een andere methode is het synthetiseren van boorbromide door boorhydriden, zoals diboraan (B2H6) of boraan (BH3), te laten reageren met waterstofbromide (HBr). Bij deze reactie ontstaan boorbromide en waterstofgas als producten.
Houd er rekening mee dat deze synthesemethoden voorzichtigheid vereisen vanwege de zeer reactieve aard van boorbromide. Tijdens het syntheseproces moeten de juiste veiligheidsprotocollen worden gevolgd, zoals het dragen van geschikte beschermende uitrusting en het werken in een goed geventileerde ruimte.
Gebruik van boortribromide
Boriumbromide (BBr3) heeft verschillende belangrijke toepassingen in verschillende industrieën. Hier zijn enkele belangrijke toepassingen:
- Katalysator: BBr3 katalyseert actief organische synthesereacties, waardoor processen zoals acylering, alkylering en halogeneringsreacties mogelijk worden.
- Chemische tussenproducten: BBr3 fungeert als een voorloper bij de productie van andere boorverbindingen, waarbij boorhoudende reagentia, boorzuren en op boor gebaseerde polymeren worden gesynthetiseerd.
- Polymerisatie: BBr3 neemt actief deel aan polymerisatiereacties, vooral bij de productie van polymeren zoals polyethyleen en polypropyleen, en dient als Lewis-zuurkatalysator.
- Dopingmiddel: De halfgeleiderindustrie maakt actief gebruik van BBr3 als dopingmiddel, waardoor de elektrische eigenschappen van silicium worden aangepast voor geschiktheid in elektronische apparaten.
- Gasdetectie: BBr3 reageert actief met specifieke gassen zoals ammoniak, waardoor het geschikt is voor gasdetectoren en sensoren die worden gebruikt voor detectie- en monitoringdoeleinden.
- Laboratoriumreagens: BBr3 dient actief als reagens in verschillende laboratoriumexperimenten en onderzoek, voert bromerreacties uit en fungeert als een bron van broomatomen in de synthetische chemie.
- Farmaceutische synthese: De farmaceutische industrie maakt actief gebruik van BBr3 bij de synthese van bepaalde geneesmiddelen en farmaceutische tussenproducten.
Het is belangrijk om zorgvuldig met boorbromide om te gaan en de juiste veiligheidsprotocollen te volgen, vanwege de corrosieve en reactieve aard ervan.
Vragen:
Vraag: Welke term beschrijft de reactiviteit van boortribromide (BBr3)?
EEN: Zeer responsief.
Vraag: Wat is de formule voor boortribromide?
A: De formule voor boorbromide is BBr3.
Vraag: Hoeveel booratomen zitten er in 3,24 gram boortribromide?
A: Er zitten 0,053 mol BBr3 in 3,24 gram, wat overeenkomt met 0,159 mol boor, of ongeveer 9,62 x 10^22 atomen.
Vraag: Hoeveel gram boortribromide kan worden geproduceerd uit 3,49 gram broom?
A: De molaire massa van BBr3 is 250,60 g/mol. Dus ongeveer 3,49 gram broom kan ongeveer 3,34 gram boorbromide produceren.
Vraag: Wat is de naam van de verbinding met de formule BBr3?
A: De verbinding met de formule BBr3 wordt boorbromide genoemd.
Vraag: Is boortribromide polair of niet-polair?
A: Boriumbromide is een polaire verbinding.
Vraag: Wat is de elektronische geometrie van BBr3?
A: De elektronische geometrie van BBr3 is planair trigonaal.
Vraag: Wat is de Lewis-structuur voor BBr3?
A: In de Lewis-structuur van BBr3 bevindt zich een booratoom in het midden omgeven door drie broomatomen.
Vraag: Hoeveel pieken in BBr3?
A: Boriumbromide (BBr3) heeft een piek in zijn NMR-spectrum.
