Booroxide (B2O3) is een verbinding die wordt gevormd door de chemische binding van boor en zuurstof. Het wordt gebruikt bij de productie van glas en keramiek vanwege het hoge smeltpunt.
| IUPAC-naam | Boriumoxide |
| Moleculaire formule | B2O3 |
| CAS-nummer | 1303-86-2 |
| Synoniemen | Triboortrioxide, booroxide, boor(III)oxide |
| InChi | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Eigenschappen van booroxide
Boriumoxide-formule
De chemische formule voor booroxide is B2O3. Het vertegenwoordigt de verhouding van booratomen tot zuurstofatomen in de verbinding. De indexcijfers geven aan dat er twee booratomen en drie zuurstofatomen aanwezig zijn in elk booroxidemolecuul.
Molaire massa van booroxide
De molaire massa van booroxide kan worden berekend door de atoommassa’s van de samenstellende elementen op te tellen. Borium heeft een atoommassa van 10,81 g/mol, terwijl zuurstof een atoommassa heeft van 16,00 g/mol. Door de atoommassa’s te vermenigvuldigen met het respectieve aantal atomen en deze op te tellen, wordt de molaire massa van booroxide bepaald op 69,62 g/mol.
Kookpunt van booroxide
Booroxide heeft een hoog kookpunt van ongeveer 1.860 graden Celsius. Dit betekent dat het bij normale atmosferische druk aanzienlijke energie kost om booroxide van zijn vloeibare toestand naar zijn gasvormige toestand om te zetten.
Smeltpunt van booroxide
Het smeltpunt van booroxide ligt rond de 450 graden Celsius. Bij deze temperatuur verandert vast booroxide in een vloeibare toestand. Het relatief lage smeltpunt maakt het geschikt voor diverse industriële toepassingen.
Dichtheid van booroxide g/ml
Booroxide heeft een dichtheid van ongeveer 2,46 g/ml. Dichtheid verwijst naar de massa per volume-eenheid van een stof. De dichtheid van booroxide geeft aan dat het relatief dicht is, waardoor het in de meeste vloeistoffen kan stromen.
Molecuulgewicht van booroxide
Het molecuulgewicht van booroxide, ook wel molmassa genoemd, is 69,62 g/mol. Deze waarde vertegenwoordigt de massa van één mol van de verbinding en is nuttig voor het berekenen van de hoeveelheid booroxide in een bepaald monster.
Structuur van booroxide
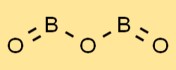
Booroxide heeft een unieke structuur, met een reeks trigonale vlakke BO3-eenheden. De booratomen zijn omgeven door drie driehoekig gerangschikte zuurstofatomen. Deze opstelling geeft booroxide zijn karakteristieke eigenschappen en stabiliteit.
Oplosbaarheid van booroxide
Booroxide is onoplosbaar in water en de meeste organische oplosmiddelen. De oplosbaarheid ervan is beperkt in zuren zoals zwavelzuur en zoutzuur. Deze lage oplosbaarheid draagt bij aan de stabiliteit en bruikbaarheid ervan in verschillende toepassingen, zoals de productie van glas en keramiek.
| Verschijning | Witte vaste stof |
| Soortelijk gewicht | 2,46 g/ml |
| Kleur | Wit |
| Geur | Geurloos |
| Molaire massa | 69,62 g/mol |
| Dikte | 2,46 g/ml |
| Fusie punt | 450°C |
| Kookpunt | 1860°C |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Onoplosbaar |
| Oplosbaarheid | Beperkte oplosbaarheid in zuren, zoals zwavelzuur en zoutzuur |
| Dampdruk | Niet toepasbaar |
| Dampdichtheid | Niet toepasbaar |
| pKa | Niet toepasbaar |
| pH | Niet toepasbaar |
Houd er rekening mee dat sommige eigenschappen, zoals vlampunt, dampdruk, dampdichtheid, pKa en pH, niet van toepassing zijn of niet zijn gerapporteerd voor booroxide.
Veiligheid en gevaren van booroxide
Booroxide brengt bepaalde veiligheids- en gevaaroverwegingen met zich mee. Direct contact met booroxidepoeder of stof kan de huid, ogen en luchtwegen irriteren. Het is belangrijk om er voorzichtig mee om te gaan en de juiste persoonlijke beschermingsmiddelen te gebruiken, zoals handschoenen en een veiligheidsbril. Het inademen van booroxidedeeltjes kan irritatie van de luchtwegen veroorzaken, dus het is raadzaam om in goed geventileerde ruimtes te werken. In geval van accidentele inname moet onmiddellijk medische hulp worden ingeroepen. Booroxide is niet brandbaar en heeft geen vlampunt. Zoals bij elke chemische stof wordt aanbevolen de juiste richtlijnen voor hantering en opslag te volgen om een veilig gebruik te garanderen.
| Gevarensymbolen | Niet geclassificeerd |
| Beveiligingsbeschrijving | Vermijd contact met huid en ogen. Gebruik in een goed geventileerde ruimte. Draag beschermende uitrusting. |
| VN-identificatienummers | Niet toepasbaar |
| HS-code | 2810.00.2000 |
| Gevarenklasse | Niet geclassificeerd |
| Verpakkingsgroep | Niet toepasbaar |
| Toxiciteit | Lage tot matige toxiciteit. Kan irritatie veroorzaken bij contact of inademing. |
Houd er rekening mee dat booroxide geen gevarensymbolen, UN-identificatie, gevarenklasse of verpakkingsgroep draagt. Het is belangrijk om de algemene veiligheidsrichtlijnen en -praktijken te volgen bij het hanteren en gebruiken van booroxide om het risico op blootstelling te minimaliseren en een veilig gebruik te garanderen.
Methoden voor de synthese van booroxide
Verschillende methoden maken de synthese van booroxide mogelijk. Een veelgebruikte aanpak is het verwarmen van elementair boor in aanwezigheid van zuurstof of lucht om booroxide te creëren. Een andere methode omvat het laten reageren van boorhalogeniden, zoals boortrichloride (BCl3) of boortribromide (BBr3), met water, wat resulteert in de vorming van booroxide.
Bovendien kunnen boorhoudende verbindingen zoals boornitride of boortrisulfide hydrolyse met water ondergaan om booroxide te produceren. De thermische ontleding van boraten, zoals natriumboraat of borax , produceert bij blootstelling aan hitte ook booroxide.
Het is belangrijk op te merken dat de keuze voor een specifieke synthesemethode afhangt van de gewenste zuiverheid, hoeveelheid en toepassing van het booroxide. Elke methode heeft voordelen en kan geschikt zijn voor verschillende situaties.
Gebruik van booroxide
Booroxide vindt verschillende toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Glas- en keramiekproductie: booroxide is een belangrijk ingrediënt bij de vervaardiging van glas en keramiek. Het geeft glasproducten gewenste eigenschappen zoals hittebestendigheid, transparantie en duurzaamheid.
- Vlamvertragers: Fabrikanten gebruiken booroxide als vlamvertrager in materialen zoals textiel, kunststoffen en houtproducten. Booroxide vermindert de ontvlambaarheid van deze materialen, waardoor de veiligheid wordt vergroot.
- Borosilicaatglas: Boriumoxide speelt een cruciale rol als onderdeel van borosilicaatglas, bekend om zijn lage thermische uitzetting en hoge hittebestendigheid. Industrieën gebruiken dit type glas in laboratoriumapparatuur, keukengerei en hoogwaardige optische apparaten.
- Speciale vezels: Bij de productie van speciale vezels, waaronder boorvezels en boornitridevezels, wordt booroxide gebruikt. Deze vezels beschikken over uitzonderlijke mechanische en thermische eigenschappen, waardoor ze geschikt zijn voor de lucht- en ruimtevaart-, automobiel- en hightechindustrie.
- Boriumchemicaliën: Booroxide dient als voorloper voor de synthese van verschillende boorchemicaliën, zoals boraten en boorhydriden. Deze chemicaliën vinden toepassingen in de landbouw, de farmaceutische industrie en energieopslagsystemen.
- Soldeervloeimiddelen en -middelen: booroxide verlaagt het smeltpunt van materialen en verbetert hun vloeibaarheid, waardoor het een effectief vloeimiddel wordt in metallurgische processen. Het verbetert de hechting van metalen oppervlakken bij gebruik als soldeermiddel.
- Katalysatoren: Chemische reacties profiteren van booroxidekatalysatoren omdat ze gewenste reacties bevorderen en de reactiesnelheden verhogen.
- Halfgeleiderindustrie: booroxide speelt een cruciale rol bij de productie van halfgeleiders. Het fungeert als dopingmateriaal om de elektrische eigenschappen van silicium actief te wijzigen.
Het brede scala aan toepassingen van booroxide benadrukt de veelzijdigheid en het belang ervan in verschillende industrieën, wat bijdraagt aan vooruitgang op het gebied van technologie, veiligheid en materiaalkunde.
Vragen:
Vraag: Wat is de oxidatietoestand van boor in B2O3?
A: De oxidatietoestand van boor in B2O3 is +3.
Vraag: Wat is de empirische formule voor booroxide?
A: De empirische formule voor booroxide is B2O3.
Vraag: Wanneer zal de oppervlakteconcentratie van boor de groeisnelheid van het oxide beïnvloeden?
A: De oppervlakteconcentratie van boor zal de groeisnelheid van het oxide beïnvloeden wanneer het als doteringsmiddel of katalysator in het oxidatieproces fungeert.
Vraag: Wat is Boria-booroxide?
A: Booroxide, ook bekend als boria, is een verbinding met de chemische formule B2O3.
Vraag: Wat is het oxidatiegetal van boor?
A: Borium heeft over het algemeen een oxidatiegetal van +3.
Vraag: Zal boor de oxidatie in zuurstofarme materialen vertragen?
A: Borium vertraagt de oxidatie in zuurstofarme materialen niet, omdat er zuurstof nodig is om booroxide te vormen.
Vraag: Wat is de oxidatietoestand van boor in HBO2 in CuO?
A: De oxidatietoestand van boor in HBO2 is +3.
Vraag: Hoeveel mol B2O3 kunnen er gevormd worden?
A: Het aantal gevormde mol B2O3 hangt af van de hoeveelheid reactanten die bij de reactie worden gebruikt.
Vraag: Is B2O3 ionisch of moleculair?
A: B2O3 is een ionische verbinding.
Vraag: Welk paar wordt vermeld in volgorde van toenemende basiciteit? PBO < SiO2 B2O3 < Li2O
A: Het paar vermeld in volgorde van toenemende basiciteit is B2O3 < Li2O < PBO < SiO2.
Vraag: B2H6 + O2 → B2O3 + H2O, is deze vergelijking in evenwicht?
A: Nee, de vergelijking is niet in evenwicht. Dit vereist aanpassingen om tot een evenwichtige vergelijking te komen.
Vraag: Hoeveel boor kun je krijgen uit 210,0 pond B2O3?
A: De hoeveelheid boor die uit 210,0 pond B2O3 wordt verkregen, hangt af van de molaire massa en de stoichiometrie van de reactie.
