Waterstofcyanide is een zeer giftige stof die in de industrie wordt gebruikt en bekend staat om zijn dodelijke effecten op de luchtwegen. Het is kleurloos, heeft een duidelijke geur en brengt aanzienlijke risico’s voor de menselijke gezondheid met zich mee.
| IUPAC-naam | Waterstofcyanide |
| Moleculaire formule | HCN |
| CAS-nummer | 74-90-8 |
| Synoniemen | Blauwzuur, Formonitril, Blauwzuur, Blauwzuur |
| InChi | InChI=1S/CHN/c1-2/h1H |
Eigenschappen van waterstofcyanide
Waterstofcyanide-formule
De formule voor blauwzuur is HCN. Het bestaat uit een waterstofatoom (H) dat via een drievoudige binding aan een koolstofatoom (C) is gebonden, en het koolstofatoom is verder gebonden aan een stikstofatoom (N). Deze eenvoudige molecuulformule vertegenwoordigt de samenstelling van blauwzuur.
Waterstofcyanide Molaire massa
De molaire massa van blauwzuur is ongeveer 27,03 gram per mol. Het wordt berekend door de atoommassa’s van waterstof (H), koolstof (C) en stikstof (N) op te tellen die aanwezig zijn in een molecuul blauwzuur.
Kookpunt van waterstofcyanide
Waterstofcyanide heeft een kookpunt van ongeveer 25,7 graden Celsius (78,3 graden Fahrenheit). Bij deze temperatuur verandert blauwzuur van vloeibare naar gasvormige toestand, waarbij giftige dampen vrijkomen.
Smeltpunt van waterstofcyanide
Het smeltpunt van blauwzuur is ongeveer -13,4 graden Celsius (7,9 graden Fahrenheit). Bij deze temperatuur verandert blauwzuur van vaste naar vloeibare toestand.
Dichtheid van waterstofcyanide g/ml
De dichtheid van blauwzuur is ongeveer 0,687 gram per milliliter. Deze dichtheidswaarde vertegenwoordigt de massa blauwzuur per volume-eenheid.
Waterstofcyanide Moleculair gewicht
Het molecuulgewicht van blauwzuur is ongeveer 27,03 gram per mol. Het wordt bepaald door de atoomgewichten van de samenstellende elementen op te tellen.
Structuur van waterstofcyanide
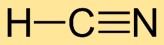
Waterstofcyanide heeft een lineaire moleculaire structuur, waarbij het waterstofatoom (H) gebonden is aan het koolstofatoom (C) en het koolstofatoom (C) gebonden is aan het stikstofatoom (N). De drievoudige binding tussen koolstof en stikstof geeft stabiliteit aan het molecuul.
Oplosbaarheid van waterstofcyanide
Blauwzuur is zeer oplosbaar in water. Het lost gemakkelijk op in water en vormt een kleurloze oplossing. Door deze oplosbaarheid kan blauwzuur zich gemakkelijk mengen en interageren met andere stoffen in verschillende toepassingen en omgevingen.
| Verschijning | Kleurloos gas |
| Soortelijk gewicht | 0,687 |
| Kleur | Kleurloos |
| Geur | Duidelijke geur |
| Molaire massa | 27,03 g/mol |
| Dikte | 0,687 g/ml |
| Fusie punt | -13,4°C (-7,9°F) |
| Kookpunt | 25,7°C (78,3°F) |
| Flitspunt | -17,8°C (0°F) |
| oplosbaarheid in water | Mengbaar met water |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen zoals ether en ethylalcohol |
| Dampdruk | 500 mmHg bij 20°C |
| Dampdichtheid | 0,95 |
| pKa | 9.3 |
| pH | 5.6 (verdund blauwzuur) |
Veiligheid en gevaren van waterstofcyanide
Waterstofcyanide brengt aanzienlijke veiligheidsrisico’s met zich mee en moet met uiterste voorzichtigheid worden gehanteerd. Het is zeer giftig bij inademing, inname of opname via de huid. Blootstelling aan blauwzuur kan ernstige ademhalingsproblemen, hartstilstand en zelfs de dood veroorzaken. Het is belangrijk om voor voldoende ventilatie te zorgen en persoonlijke beschermingsmiddelen te gebruiken wanneer u met of in de buurt van blauwzuur werkt. Bovendien is de verbinding brandbaar en kan met lucht explosieve mengsels vormen. Opslag moet plaatsvinden in goed gesloten containers, uit de buurt van ontstekingsbronnen. Er moeten noodprotocollen bestaan, zoals het verstrekken van onmiddellijke medische zorg en het evacueren van getroffen gebieden, om de risico’s die gepaard gaan met blootstelling aan blauwzuur te beperken.
| Gevarensymbolen | Schedel en gekruiste knekels |
| Beveiligingsbeschrijving | Zeer giftig; ga er uiterst voorzichtig mee om |
| VN-identificatienummers | UN1051 (Waterstofzuur) |
| HS-code | 2811.11.00 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | ik (groot gevaar) |
| Toxiciteit | Extreem giftig; kan zelfs in kleine hoeveelheden dodelijk zijn |
Synthesemethoden voor waterstofcyanide
Verschillende methoden kunnen blauwzuur synthetiseren.
Een veelgebruikte methode is het Andrussow-proces. In dit proces vergemakkelijken platina- of rhodiumkatalysatoren de reactie van ammoniak (NH₃) en methaan (CH₄) met zuurstof (O₂) om blauwzuur te synthetiseren. De reactie vindt plaats bij hoge temperaturen, gewoonlijk rond de 1000 tot 1200°C. Methaan werkt als een reductiemiddel en zet zuurstof om in water (H₂O), terwijl ammoniak de stikstofbron vormt. Het resulterende mengsel ondergaat een reeks reacties die leiden tot de vorming van blauwzuur (HCN) en waterdamp.
Een andere methode voor het synthetiseren van blauwzuur is het BMA-proces. Het gaat hierbij om de reactie van methaan (CH₄) met ammoniak (NH₃) in aanwezigheid van een katalysator, zoals koper of nikkel, bij hoge temperatuur. Dit proces genereert blauwzuur en andere bijproducten.
Het Andrussov-Noddack-proces produceert blauwzuur door natriumcyanide (NaCN) te laten reageren met een sterk zuur, zoals zwavelzuur (H₂SO₄).
Het is vermeldenswaard dat blauwzuur een zeer giftige verbinding is en dat de synthese ervan met grote zorg moet worden uitgevoerd in goed uitgeruste faciliteiten, met inachtneming van de juiste veiligheidsprotocollen. Het gebruik van gespecialiseerde apparatuur, adequate ventilatie en naleving van de veiligheidsinstructies zijn essentieel om het welzijn van het personeel dat betrokken is bij het syntheseproces te garanderen.
Gebruik van waterstofcyanide
Waterstofcyanide vindt vanwege zijn unieke eigenschappen toepassingen in verschillende industrieën. Hier zijn enkele toepassingen:
- Chemische productie: Blauwzuur speelt een cruciale rol bij de synthese van verschillende belangrijke chemicaliën, waaronder adiponitril (een sleutelcomponent bij de productie van nylon), methylmethacrylaat (gebruikt voor acrylkunststoffen) en natriumcyanide (gebruikt in de goudwinning).
- Farmaceutische producten: De productie van farmaceutische producten, zoals vitamines, synthetische aminozuren en sommige antibiotica, is afhankelijk van blauwzuur.
- Begassing: Industrieën gebruiken blauwzuur als ontsmettingsmiddel om ongedierte onder controle te houden, vooral in afgesloten ruimtes zoals kassen, scheepsruimen en graanopslagfaciliteiten.
- Metaalbeplating: Metallurgische industrieën gebruiken blauwzuur voor galvaniseerprocessen om een beschermende laag op metalen oppervlakken aan te brengen.
- Polymeerproductie: Waterstofcyanide neemt actief deel aan de productie van synthetische vezels, rubber en harsen.
- Insecticiden: Sommige insecticiden bevatten actieve ingrediënten afgeleid van blauwzuur om effectieve ongediertebestrijding in de land- en bosbouw te bieden.
- Laboratoriumreagens: Waterstofcyanide dient als reagens bij verschillende chemische reacties en laboratoriumprocedures.
- Mijnbouw: Bij de goud- en zilverwinning fungeert blauwzuur als een chemisch reagens om edele metalen uit ertsen te winnen.
- Productie van synthetisch rubber: Waterstofcyanide dient als grondstof bij de productie van synthetisch rubber, zoals styreen-butadieenrubber (SBR).
- Kleurstoffen en pigmenten: Bij de vervaardiging van kleurstoffen en pigmenten wordt gebruik gemaakt van blauwzuur, wat bijdraagt aan hun kleureigenschappen.
Hoewel blauwzuur zijn toepassingen heeft, is het vanwege de hoge toxiciteit belangrijk om er met grote voorzichtigheid mee om te gaan. Strikte veiligheidsprotocollen en het volgen van de juiste hanteringsprocedures zijn essentieel om de risico’s die aan het gebruik ervan zijn verbonden tot een minimum te beperken.
Vragen:
Vraag: Waar wordt waterstofcyanide voor gebruikt?
A: Waterstofcyanide wordt onder andere gebruikt bij de chemische productie, farmaceutische productie, begassing, verzinking, insecticiden en als laboratoriumreagens.
Vraag: Wat is de chemische formule van waterstofcyanide?
A: De chemische formule voor blauwzuur is HCN.
Vraag: Wat zijn de “toegestane toepassingen” van waterstofcyanide?
A: De “toegestane doeleinden” van MCN omvatten het goedgekeurde en gereguleerde gebruik ervan in specifieke industriële processen, onderzoek en andere toegestane toepassingen.
Vraag: Waar zit waterstofcyanide in?
A: Waterstofcyanide kan worden aangetroffen in verschillende chemicaliën, industriële omgevingen en natuurlijke bronnen zoals bepaalde planten en zaden.
Vraag: Waar kun je waterstofcyanide kopen?
A: De aankoop van waterstofcyanide is zeer beperkt en gereguleerd vanwege de toxiciteit en het mogelijke misbruik ervan.
Vraag: Wat is waterstofcyanide?
A: Waterstofcyanide is een zeer giftige en vluchtige verbinding met een duidelijke geur, die vaak wordt gebruikt in industriële processen.
Vraag: Is waterstofcyanide polair of niet-polair?
A: Waterstofcyanide is een polair molecuul vanwege de aanwezigheid van polaire bindingen en een asymmetrische verdeling van de elektronendichtheid.
Vraag: Welk woord of welke zin van twee woorden beschrijft het beste de vorm van het waterstofcyanidemolecuul (HCN)?
A: De vorm van het HCN-molecuul is lineair.
Vraag: Waar wordt waterstofcyanide voor gebruikt?
A: Waterstofcyanide wordt in verschillende industrieën gebruikt voor chemische synthese, begassing, verzinking, insecticiden en farmaceutische productie.
Vraag: Werd waterstofcyanide gebruikt bij een terroristische aanslag?
A: Ja, HCN is in het verleden gebruikt als chemisch wapen bij terroristische aanslagen.
Vraag: Wat zijn andere chemische namen die verband houden met waterstofcyanide?
A: Andere chemische namen die verband houden met HCN zijn blauwzuur, formonitril, blauwzuur en blauwzuur.
Vraag: Wat is het juiste Lewis-puntdiagram voor waterstofcyanide?
A: Het juiste Lewis-puntdiagram voor HCN omvat het waterstofatoom (H) dat via een enkele binding aan het koolstofatoom (C) is gebonden, en het koolstofatoom (C) dat via een drievoudige binding aan het stikstofatoom (N) is gebonden.
Vraag: Wat is de lading van de atomen van waterstofcyanide?
A: In HCN heeft het waterstofatoom (H) een positieve gedeeltelijke lading, het koolstofatoom (C) een negatieve gedeeltelijke lading en het stikstofatoom (N) een negatieve gedeeltelijke lading.
Vraag: Wat doet een waterstofcyanidecapsule met je?
A: In sterk gereguleerde en gecontroleerde omgevingen kan een HCN-capsule worden gebruikt als een snelle en dodelijke manier van zelftoediening, meestal voor geheime doeleinden of voor noodgevallen.
Vraag: Welk type binding is de koolstof-stikstofbinding in een waterstofcyanide (HCN)-molecuul?
A: De koolstof-stikstofbinding in een HCN-molecuul is een drievoudige binding.
