Bijtende potas (KOH) of kaliumhydroxide is een zeer corrosieve alkalische stof die wordt gebruikt bij de productie van zepen, wasmiddelen en andere chemicaliën. Het reageert heftig met zuren en kan ernstige huid- en oogirritatie veroorzaken.
| IUPAC-naam | Kaliumhydroxide |
| Moleculaire formule | KOH |
| CAS-nummer | 1310-58-3 |
| Synoniemen | Kaliumloog, kaliumhydraat, bijtende potasoplossing, kaliumhydroxidetabletten, KOH |
| InChi | InChI=1S/K.1H2O/h;1H2/q+1;/p-1 |
Molaire massa van kaliumhydroxide
Kaliumhydroxide (KOH) heeft een molmassa van 56,11 g/mol, wat de som is van de atoomgewichten van kalium (39,10 g/mol) en zuurstof (16,00 g/mol) plus één waterstofatoom (1,01 g/mol). De molaire massa van KOH is belangrijk bij verschillende chemische berekeningen, waaronder stoichiometrie en het bepalen van de hoeveelheid KOH die nodig is om met andere stoffen te reageren. Het wordt ook gebruikt om massa, mol en volume KOH om te zetten in verschillende chemische reacties.
Kaliumhydroxide-formule
De chemische formule voor bijtende potas bestaat uit een kaliumion (K+) en een hydroxide-ion (OH-), waardoor het de formule KOH krijgt. De formule vertegenwoordigt het aantal en het type atomen waaruit een enkele eenheid kaliumhydroxide bestaat. De formule wordt gebruikt bij verschillende chemische berekeningen, waaronder stoichiometrie en het bepalen van de hoeveelheid kaliumhydroxide die nodig is voor een bepaalde reactie.
Kookpunt van kaliumhydroxide
Kaliumhydroxide heeft een hoog kookpunt van 1,327 ° C (2,421 ° F). Dit hoge kookpunt is te wijten aan de ionische aard ervan, die een aanzienlijke hoeveelheid energie vereist om de bindingen tussen de kalium- en hydroxide-ionen te verbreken. KOH wordt gebruikt als sterke base en elektrolyt in verschillende chemische processen en is door zijn hoge kookpunt geschikt voor toepassingen bij hoge temperaturen.
Smeltpunt van kaliumhydroxide
Kaliumhydroxide heeft een smeltpunt van 360°C (680°F). Dit hoge smeltpunt is ook te danken aan de ionische aard ervan, die een aanzienlijke hoeveelheid energie vereist om de bindingen tussen kalium- en hydroxide-ionen te verbreken. KOH wordt vaak gebruikt bij de productie van zepen, wasmiddelen en andere chemicaliën, en het hoge smeltpunt zorgt ervoor dat het bij kamertemperatuur in vaste toestand blijft.
Dichtheid van kaliumhydroxide g/ml
Kaliumhydroxide heeft een dichtheid van 2,044 g/ml bij kamertemperatuur. Deze hoge dichtheid is te wijten aan de smalheid van de KOH-moleculen in de vaste toestand. De dichtheid van KOH is belangrijk bij het bepalen van het volume en de massa van KOH die nodig zijn bij verschillende chemische reacties. Het wordt ook gebruikt om de concentratie van KOH-oplossingen in termen van massa per volume te bepalen.
Structuur van kaliumhydroxide
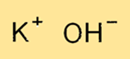
Kaliumhydroxide heeft een kristalstructuur die bestaat uit kaliumionen (K+) en hydroxide-ionen (OH-) die op een ordelijke manier zijn gerangschikt. Het KOH-kristalrooster is een driedimensionaal netwerk van ionen die bij elkaar worden gehouden door ionische bindingen. De kristalstructuur van KOH geeft het zijn karakteristieke fysische en chemische eigenschappen.
Molecuulgewicht van kaliumhydroxide
Het molecuulgewicht van kaliumhydroxide is 56,11 g/mol. Het is de som van de atoomgewichten van kalium, zuurstof en waterstof in KOH. Het molecuulgewicht van KOH is belangrijk bij verschillende chemische berekeningen, waaronder het bepalen van de hoeveelheid KOH die nodig is voor een bepaalde chemische reactie.
| Verschijning | Witte of kleurloze vaste stof |
| Soortelijk gewicht | 2,044 g/ml bij 25°C |
| Kleur | Kleurloos |
| Geur | Geurloos |
| Molaire massa | 56,11 g/mol |
| Dikte | 2,044 g/ml bij 25°C |
| Fusie punt | 360°C (680°F) |
| Kookpunt | 1.327°C (2.421°F) |
| Flitspunt | Niet toepasbaar |
| oplosbaarheid in water | Volledig oplosbaar in water |
| Oplosbaarheid | Oplosbaar in ethanol, methanol |
| Dampdruk | 0,01 mmHg bij 25°C |
| Dampdichtheid | Niet toepasbaar |
| pKa | 13.5 |
| pH | 13,5 – 14,0 |
Bijtende kalium (KOH) veiligheid en gevaren
Bijtende potas (KOH) is een zeer bijtende stof die ernstige brandwonden kan veroorzaken als deze in contact komt met de huid of ogen. Het kan ook schadelijk zijn als het wordt ingeademd of ingeslikt. De stof moet met voorzichtigheid worden gehanteerd en bij het hanteren ervan moeten geschikte persoonlijke beschermingsmiddelen worden gedragen. Bij contact met de huid of ogen moet het aangetaste gebied onmiddellijk gedurende minimaal 15 minuten met water worden gespoeld. Bijtende potas (KOH) moet worden opgeslagen in een koele, droge, goed geventileerde ruimte, uit de buurt van onverenigbare stoffen zoals zuren en oxidatiemiddelen. Bij het hanteren en transporteren van de stof moeten passende etiketterings- en veiligheidsinformatie worden verstrekt.
| Gevarensymbolen | Bijtend |
| Beveiligingsbeschrijving | Veroorzaakt ernstige brandwonden en oogletsel. Schadelijk bij inademing of inslikken. |
| AN-identificaties | VN1813 |
| HS-code | 2815.12.00 |
| Gevarenklasse | 8 – Bijtende stoffen |
| Verpakkingsgroep | II |
| Toxiciteit | Zeer giftig |
Methoden voor de synthese van bijtende potas (KOH)
Bijtende potas (KOH) kan op verschillende manieren worden gesynthetiseerd.
- Een gebruikelijke methode voor het synthetiseren van KOH omvat het elektrolyseren van een kaliumchloride (KCl) -oplossing met behulp van een membraancel. In dit proces migreren kaliumionen naar de kathode en ondergaan reductie om metallisch kalium te produceren, dat reageert met water om KOH en waterstofgas te produceren. Chloride-ionen migreren naar de anode en ondergaan oxidatie om chloorgas te produceren.
- Een andere methode om KOH te synthetiseren is de reactie van kaliumcarbonaat (K2CO3) met calciumhydroxide (Ca(OH)2) in een metathesereactie. De resulterende producten zijn CaCO3 en KOH, en het CaCO3 kan worden uitgefilterd, waardoor een KOH-oplossing achterblijft.
- De reactie tussen KOH en CO2 levert kaliumbicarbonaat (KHCO3). Bij het verwarmen van kaliumbicarbonaat (KHCO3) komt koolstofdioxide vrij en blijft zuivere KOH over.
- De reactie van kaliumchloride (KCl) met calciumhydroxide (Ca(OH)2) levert een oplossing op die bij elektrolyse KOH en waterstofgas produceert.
De keuze van de KOH-synthesemethode hangt af van factoren zoals de kosten, beschikbaarheid van reagentia en de gewenste zuiverheid van het eindproduct.
Gebruik van bijtende potas (KOH)
- Verschillende industrieën en commerciële toepassingen gebruiken bijtende potas (KOH) als een solide basis bij de productie van chemicaliën zoals kaliumcarbonaat, kaliumpermanganaat en kaliumfosfaat.
- Bijtende potas (KOH) helpt bij het emulgeren van vetten en oliën, waardoor het ideaal is voor gebruik bij de productie van vloeibare zepen en wasmiddelen.
- Boeren gebruiken bijtende potas (KOH) als meststof om kalium te leveren, een essentiële voedingsstof voor plantengroei, en bij de productie van insecticiden en fungiciden.
- Bij de productie van batterijen, met name nikkel-metaalhydridebatterijen, wordt bijtende potas (KOH) gebruikt om de prestaties en levensduur te verbeteren.
- In de farmaceutische industrie produceert bijtende potas (KOH) kaliumsupplementen en sommige antibiotica.
- Bijtende potas (KOH) speelt ook een rol bij de productie van biodiesel en fungeert als katalysator bij de productie van synthetisch rubber.
- Analytische chemische toepassingen maken gebruik van kaliloog (KOH) voor de titratie van zuren en de bereiding van standaardoplossingen.
- Bijtende potas (KOH) behandelt verschillende soorten afval, zoals zuur afvalwater en industrieel afvalwater.
Vragen:
Vraag: Is kaliumhydroxide een sterke base?
A: Ja, kaliumhydroxide (KOH) is een sterke base.
Vraag: Wat is kaliumhydroxide?
A: Kaliumhydroxide (KOH) is een witte, geurloze vaste stof die vaak wordt gebruikt als vaste basis in verschillende industriële en commerciële toepassingen.
Vraag: Is kaliumhydroxide oplosbaar?
A: Ja, kaliumhydroxide is zeer oplosbaar in water, met een oplosbaarheid van ongeveer 121 g/100 ml bij kamertemperatuur.
Vraag: Welke producten ontstaan uit de reactie van zwavelzuur (H2SO4) met kaliumhydroxide (KOH)?
A: De reactie van zwavelzuur (H2SO4) met kaliumhydroxide (KOH) produceert kaliumsulfaat (K2SO4) en water (H2O).
H2SO4 + 2KOH → K2SO4 + 2H2O
Vraag: Wat is de formule voor kaliumhydroxide?
A: De formule voor kaliumhydroxide is KOH.
