Benzylchloride is een chemische verbinding die in verschillende industrieën wordt gebruikt. Het is afgeleid van benzeen en vindt toepassingen in farmaceutische producten, kleurstoffen en parfums.
| IUPAC-naam | Benzylchloride |
| Moleculaire formule | C₇H₇Cl |
| CAS-nummer | 100-44-7 |
| Synoniemen | α-chloortolueen, benzylchloride, chloormethylbenzeen, fenylmethylchloride |
| InChi | InChI=1S/C7H7Cl/c8-6-7-4-2-1-3-5-7/h1-5H,6H2 |
Eigenschappen van benzylchloride
Benzylchloride-formule
De chemische formule voor benzylchloride is C7H7Cl of C6H5CH2Cl. Het bestaat uit zeven koolstofatomen, zeven waterstofatomen en één chlooratoom. De formule vertegenwoordigt de rangschikking van deze atomen in het molecuul en biedt waardevolle informatie over de samenstelling ervan.
Benzylchloride Molaire massa
De molaire massa van benzylchloride wordt berekend door de atoommassa’s van de samenstellende elementen op te tellen. In dit geval heeft koolstof een molaire massa van 12,01 g/mol, heeft waterstof een molaire massa van 1,01 g/mol en heeft chloor een molaire massa van 35,45 g/mol. Als je ze bij elkaar optelt, bedraagt de molaire massa van benzylchloride ongeveer 126,58 g/mol.
Kookpunt van benzylchloride
Benzylchloride heeft een kookpunt van ongeveer 179°C (354°F). Deze temperatuur geeft het punt aan waarop de vloeibare toestand van benzylchloride verandert in de gastoestand onder standaard atmosferische druk. Dit is een belangrijke parameter waarmee rekening moet worden gehouden bij het hanteren en verwerken van deze verbinding.
Benzylchloride Smeltpunt
Het smeltpunt van benzylchloride is ongeveer -39°C (-38°F). Dit is de temperatuur waarbij de vaste vorm van benzylchloride overgaat in de vloeibare toestand. Kennis van het smeltpunt is essentieel voor een juiste opslag en hantering van de verbinding.
Dichtheid van benzylchloride g/ml
Benzylchloride heeft een dichtheid van ongeveer 1,10 g/ml. Dichtheid verwijst naar de massa van een stof per volume-eenheid. Deze waarde helpt bij het bepalen van de hoeveelheid benzylchloride die in een bepaald volume aanwezig is en is belangrijk voor verschillende toepassingen en berekeningen.
Benzylchloride Molecuulgewicht
Het molecuulgewicht van benzylchloride wordt berekend door de atoomgewichten van de samenstellende atomen op te tellen. Met koolstof met een gewicht van 12,01 g/mol, waterstof 1,01 g/mol en chloor 35,45 g/mol is het molecuulgewicht van benzylchloride ongeveer 126,58 g/mol.
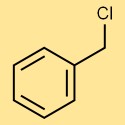
Structuur van benzylchloride
Benzylchloride heeft een moleculaire structuur die bestaat uit een benzeenring (een aromatische ring met zes koolstofatomen) met een chlooratoom bevestigd aan een van de koolstofatomen in de ring. Deze structuur staat bekend als het arylhalogenide en speelt een cruciale rol in de reactiviteit en chemische eigenschappen ervan.
Oplosbaarheid van benzylchloride
Benzylchloride is slecht oplosbaar in water. Het vertoont een betere oplosbaarheid in organische oplosmiddelen zoals ethanol en ether. Deze beperkte oplosbaarheid in water en hoge oplosbaarheid in organische oplosmiddelen beïnvloedt de toepassingen en methoden van hantering en zuivering.
| Verschijning | Kleurloze tot lichtgele vloeistof |
| Soortelijk gewicht | 1,104 g/ml |
| Kleur | Kleurloos tot lichtgeel |
| Geur | Kruidig, zoet, amandelachtig |
| Molaire massa | 126,58 g/mol |
| Dikte | 1,10 g/ml |
| Fusie punt | -39°C (-38°F) |
| Kookpunt | 179°C (354°F) |
| Flitspunt | 65°C (149°F) |
| oplosbaarheid in water | Enigszins oplosbaar |
| Oplosbaarheid | Oplosbaar in organische oplosmiddelen |
| Dampdruk | 4,9 mmHg bij 25°C |
| Dampdichtheid | 4,36 (lucht = 1) |
| pKa | 7.08 |
| pH | Ongeveer 7 |
Veiligheid en gevaren van benzylchloride
Benzylchloride brengt potentiële veiligheidsrisico’s met zich mee en moet met voorzichtigheid worden gehanteerd. Het wordt als giftig beschouwd en kan ernstige irritatie aan de ogen, huid en luchtwegen veroorzaken. Inademing of inslikken kan ademhalingsproblemen en schade aan inwendige organen veroorzaken. Direct contact met de huid kan brandwonden en dermatitis veroorzaken. Benzylchloride is ook brandbaar en de dampen ervan kunnen met lucht explosieve mengsels vormen. Adequate ventilatie, persoonlijke beschermingsmiddelen en goede opslag- en hanteringsprocedures zijn essentieel om het risico te minimaliseren. Bij blootstelling is onmiddellijke medische aandacht noodzakelijk. Het is essentieel om veiligheidsmaatregelen te volgen en veiligheidsinformatiebladen te raadplegen wanneer u met benzylchloride werkt.
| Gevarensymbolen | Schedel en gekruiste knekels |
| Beveiligingsbeschrijving | Zeer giftig bij inademing en inslikken. Veroorzaakt ernstige brandwonden en oogletsel. Ontvlambare vloeistof en damp. |
| VN-identificatienummers | Een 1738 |
| HS-code | 2903.39.10 |
| Gevarenklasse | 6.1 (giftige stoffen) |
| Verpakkingsgroep | II (gemiddeld) |
| Toxiciteit | Acute orale toxiciteit – Hoog |
Methoden voor de synthese van benzylchloride
Verschillende methoden kunnen benzylchloride synthetiseren.
Een gebruikelijke methode is de reactie tussen benzylalcohol en zoutzuur . Bij dit proces fungeert zoutzuur als reagens, waardoor de vervanging van de hydroxylgroep (-OH) in benzylalcohol door een chlooratoom wordt vergemakkelijkt. De reactie omvat in het algemeen de toepassing van warmte en het continu koken van het reactiemengsel onder refluxomstandigheden.
Een andere methode omvat de reactie tussen benzylalcohol en thionylchloride. Thionylchloride dient in dit proces zowel als reagens als oplosmiddel. De reactie maakt gebruik van een S[sub]N[/sub]2-mechanisme, waarbij thionylchloride de hydroxylgroep van de benzylalcohol vervangt door een chlooratoom.
Om benzylchloride te synthetiseren kan de chlorering van tolueen worden uitgevoerd met behulp van chloorgas of andere chloreringsmiddelen. De aanwezigheid van een katalysator, zoals ijzerchloride of aluminiumchloride, initieert de reactie en vergemakkelijkt de vervanging van een waterstofatoom in de methylgroep van tolueen door een chlooratoom.
Deze synthetische methoden maken de productie van benzylchloride op commerciële schaal mogelijk, waardoor een veelzijdige voorloper ontstaat voor verschillende organische verbindingen en toepassingen. Het is belangrijk op te merken dat veiligheidsmaatregelen en geschikte apparatuur moeten worden gebruikt bij het werken met deze chemicaliën en reacties.
Gebruik van benzylchloride
Benzylchloride vindt brede toepassingen in verschillende industrieën vanwege zijn veelzijdige aard en reactiviteit. Hier zijn enkele belangrijke toepassingen van benzylchloride:
- Farmaceutische industrie: De farmaceutische industrie gebruikt benzylchloride als een waardevol tussenproduct voor het synthetiseren van farmaceutische verbindingen, waaronder antibiotica, antihistaminica en sedativa.
- Chemische productie: Bij de chemische productie speelt benzylchloride een cruciale rol bij de productie van kleurstoffen, geur- en smaakstoffen, waardoor deze producten unieke smaakeigenschappen krijgen.
- Agrochemicaliën: Benzylchloride draagt actief bij aan de inspanningen van de landbouwindustrie om gewassen te beschermen tegen ziekten en plagen, omdat het actief deelneemt aan de synthese van pesticiden en herbiciden.
- Polymeerindustrie: De polymeerindustrie gebruikt benzylchloride bij de productie van polymeren zoals polystyreen, dat toepassingen vindt in verschillende consumptiegoederen en verpakkingsmaterialen.
- Oplosmiddel: Benzylchloride fungeert als oplosmiddel voor cellulose, harsen en andere organische verbindingen en vindt toepassingen in verfafbijtmiddelen en lijmformuleringen.
- Chemisch reagens: Benzylchloride dient als reagens voor verschillende organische transformaties, waardoor de functionele benzylgroep in de chemische synthese kan worden geïntroduceerd.
- Rubberindustrie: De rubberindustrie gebruikt benzylchloride in het vulkanisatieproces van rubber, waardoor de duurzaamheid en sterkte ervan wordt verbeterd.
- Onderzoek en ontwikkeling: Benzylchloride dient als een veelzijdige verbinding in laboratoria om verschillende chemische reacties te onderzoeken en nieuwe moleculen te ontwikkelen.
- Textielindustrie: De textielindustrie gebruikt benzylchloride bij de productie van textielhulpstoffen en bij verfprocessen.
- Productie van oppervlakteactieve stoffen: Benzylchloride speelt actief een rol bij de synthese van oppervlakteactieve stoffen die worden gebruikt in schoonmaakmiddelen, wasmiddelen en producten voor persoonlijke verzorging.
Deze uiteenlopende toepassingen benadrukken het belang van benzylchloride in verschillende industrieën en dragen bij aan de ontwikkeling van talrijke producten en verbeteringen op verschillende gebieden.
Vragen:
Vraag: Wat is de IUPAC-naam voor benzylchloride?
A: De IUPAC-naam voor benzylchloride is chloormethylbenzeen.
Vraag: Hoe kan benzylchloride worden bereid uit tolueen?
A: Benzylchloride kan worden bereid uit tolueen door chlorering met chloorgas of andere chloreringsmiddelen in aanwezigheid van een katalysator.
Vraag: Wat is meer elektrofiel: benzoylchloride of benzylchloride?
A: Benzoylchloride is elektrofieler dan benzylchloride vanwege de aanwezigheid van de elektronenzuigende carbonylgroep.
Vraag: Is benzylchloride een primair alkylhalogenide?
A: Ja, benzylchloride is een primair alkylhalogenide, omdat het chlooratoom is vastgemaakt aan een koolstofatoom dat rechtstreeks is gebonden aan de aromatische ring.
Vraag: Waar wordt benzylchloride voor gebruikt?
A: Benzylchloride is een veelzijdige verbinding die wordt gebruikt als tussenproduct bij de synthese van farmaceutische producten, kleurstoffen, geurstoffen en andere organische verbindingen.
Vraag: Kunt u bloed testen op benzylchloride?
A: Ja, bloedtesten kunnen de aanwezigheid van benzylchloride detecteren en informatie verschaffen over mogelijke blootstelling of toxiciteit.
Vraag: Is benzylchloride oplosbaar?
A: Ja, benzylchloride is oplosbaar in water en veel organische oplosmiddelen.
Vraag: Is benzylchloride giftig?
A: Benzylalcohol kan giftig zijn als het in hoge concentraties wordt ingenomen of gebruikt, en mogelijk nadelige effecten op het centrale zenuwstelsel veroorzaakt.
Vraag: Is benzylchloride ontvlambaar?
A: Ja, benzylchloride is ontvlambaar en moet met voorzichtigheid worden gehanteerd in de buurt van open vuur of ontstekingsbronnen.
